
����Ŀ�����������[(NH4)2Fe(SO4)2��6H2O�������������ױ������������Ƿ�����ѧ����Ҫ���Լ��������ڴ������������������������500��ʱ��������������ȫ�ֽ⣬�ش��������⣺
(1)��������笠�������������ȫ�ֽⷢ����������ԭ��Ӧ��������������FeO��Fe2O3��������������NH3��SO3��H2O��N2��_________��
(2)Ϊ����ֽ����ijɷ֣��������ʵ��װ�ý���ʵ�飬����A�е�������������ֽ���ȫ��
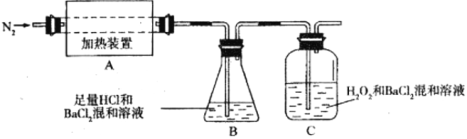
��Ϊ��֤A�в������Ƿ���FeO����Ҫѡ�õ��Լ���_________��
A.KSCN��Һ B.ϡ���� C.Ũ���� D.KMnO4��Һ
��װ��B��BaCl2��Һ��������Ϊ�˼���ֽ�������Ƿ���_________�������ɣ������и����壬�۲쵽������Ϊ___________________��
����A�зֽ������N2�����������ֻ��Fe2O3��Fe2O3�����ʵ���Ϊbmol��C�г������ʵ���Ϊamol����b_________a(����ڡ�����С�ڡ����ڡ�)
��ʵ���У��۲쵽C���а�ɫ�������ɣ���C�з�����Ӧ�����ӷ���ʽΪ________________��
(3)Ϊ�ⶨij������Ʒ��(NH4)2Fe(SO4)2��6H2O(M=392g/mol)�ĺ�����ijʵ��С����������ʵ�飺MnO4��+Fe2++H+=Mn2++Fe3++H2O(����ʽδ��ƽ)
�ⶨ���裺
����һ��ȷ����20.00g��������茶��壬���Ƴ�100mL��Һ��
�������ȡ������Һ25.00mL����ƿ�У���ϡH2SO4�ữ����0.1000mol��L��1KMnO4��Һ�ζ����յ㣬�ظ����Σ�ƽ������KMnO4��Һ16.00mL��
�ٲ�����ﵽ�ζ��յ�ı�־Ϊ________________________��
�ڲ�Ʒ��(NH4)2Fe(SO4)2��6H2O����������Ϊ____________________��
���𰸡�SO2 BD SO3 ��Һ����� С�� SO2+ H2O2+ Ba2+ = BaSO4��+2H+ �������һ�θ������ʱ����Һ���Ϻ�ɫ���Ұ����֮�ڲ���ɫ 62.72 %
��������
��1����Ԫ�غ���Ԫ�ػ��ϼ����ߣ�������������ԭ��Ӧ�л��ϼ��������н������ϼ۽��͵�Ӧ�����ݴ˷���������
��2����FeOΪ���������������ˮ���������ᣬ���ױ����������ݴ��ص㣬�ɿ��Ǽ�������KMnO4��Һ����������Fe3+��KMnO4��Һ��������ɫ������Ҫ����ָʾ����Ũ�����ױ�����������������ѡ�õ��Լ�Ϊϡ������KMnO4��Һ����ѡBC��
��BaC12����SO3��Ӧ���ɰ�ɫ������
����A�зֽ������N2�����������ֻ��Fe2O3��Fe2O3�����ʵ���Ϊbmol��C�г������ʵ���Ϊamol�����ݻ��ϼ�������ȷ���������
����˫��ˮ���������ԣ��ɽ�SO2������SO42-��SO42-����Ba2+��ϳɳ���BaSO4���ݴ˷�������
��3����ȡ������Һ25.00 mL����ƿ�У���ϡH2SO4�ữ����0.1000molL-1 KMnO4��Һ�ζ������������һ�θ��������Һ���Ϻ�ɫ�Ұ���Ӳ��䣬˵����Ӧ���յ㣻
�ڽ�ϻ�ѧ��Ӧ������ϵ���㣬MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
��1����Ԫ�غ���Ԫ�ػ��ϼ�������������������ԭ��Ӧ�л��ϼ��������н������ϼ۽��͵�Ӧ��������������������л�������SO2��
�ʴ�Ϊ��SO2��
��2����FeOΪ���������������ˮ���������ᣬ���ױ����������ݴ��ص㣬�ɿ��Ǽ�������KMnO4��Һ����������Fe3+��KMnO4��Һ��������ɫ������Ҫ����ָʾ����Ũ�����ױ�����������������ѡ�õ��Լ�Ϊϡ������KMnO4��Һ��B��D��ȷ��
�ʴ�Ϊ��BD��
��װ��B��BaC12��Һ��������Ϊ�˼���ֽ�������Ƿ���SO3�������ɣ������и����壬���������ᱵ��ɫ�������仯ѧ����ʽΪ��BaC12+SO3+H2O = BaSO4��+2HC1����۲쵽�Ĺ���Ϊ��Һ����ǣ�
�ʴ�Ϊ��SO3����Һ����ǣ�
����A�зֽ������N2�����������ֻ��Fe2O3��Fe2O3�����ʵ���Ϊb mol��C�г������ʵ���Ϊa mol�����ݻ��ϼ�������������͵Ļ��ϼ�(2a)���������ߵĻ��ϼ�(2b)�͵����ߵĻ��ϼ�֮�ͣ���bС��a��
�ʴ�Ϊ��С�ڣ�
��C���а�ɫ��������,����ΪSO2��˫��ˮ������SO42��SO42����Ba2+��ϳɳ���BaSO4����C�з����ķ�ӦΪSO2+ H2O2+ Ba2+ = BaSO4��+2H+��
�ʴ�Ϊ��SO2+ H2O2+ Ba2+ = BaSO4��+2H+��
(3)��ȡ������Һ25.00 mL����ƿ������ϡH2SO4�ữ����0.1000 molL1KMnO4��Һ�ζ����յ����μ����һ��KMnO4��Һʱ����Һ���Ϻ�ɫ�Ұ���Ӳ���ɫ��
�ʴ�Ϊ���μ����һ��KMnO4��Һʱ����Һ����ɫ�Ұ���Ӳ���ɫ��
�� MnO4+5Fe2++8H+=Mn2++5Fe3++4H2O
1 5
0.01600 L��0.1000 molL1 n
n=5��0.01600 L��0.1000 mol L-1=0.008 mol��
100 mL��Һ�к������������ʵ��� = 0.008 mol��![]() = 0.032 mol��
= 0.032 mol��
��Ʒ��(NH4)2Fe(SO4)2��6H2O���������� = ![]() ��100% = 62.72%��
��100% = 62.72%��
�ʴ�Ϊ��62.72%��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��NO��CO��Ⱦ�ﴦ�����Խ��������й�������Ҫ���塣
��1����NO2(g)+CO(g)==CO2(g)+NO(g)��H1=-234.00kJ/mol
��1/2N2(g)+1/2O2(g)=NO(g)��H2=-89.75kJ/mol
��2NO(g)+O2(g)==2NO2(g)��H3=-112.30kJ/mol��
��NO2�����CO���巴Ӧ��������Ⱦ���������Ȼ�ѧ����ʽΪ______________��
��2��ij�¶��£���10L�ܱ������зֱ����0.1molNO2��0.2molCO��������Ӧ��2NO2(g)+4CO(g)=N2(g)+4CO2(g)����10min��Ӧ�ﵽƽ����������ѹǿ��Ϊԭ����![]() ��
��
��0��10min����CO��ƽ����Ӧ����v(CO)=__________��
���������й۲쵽_____�����жϸ÷�Ӧ�ﵽƽ��״̬��
��Ϊ������Ⱦ�ﴦ��Ч�ʣ���ʼ���Ͷ�ϱ�Ϊ______��
��ƽ�����CO��CO2����Ũ�ȷֱ�����һ������ƽ��_____(���������������������������ƶ���)��

��3���ڸ�Ч������������NH3��ԭNO2������Ⱦ�ﴦ����
����ͬ�����£�ѡ��A��B��C���ִ������з�Ӧ�����ɵ��������ʵ�����ʱ��仯��ͼa�������С����______(��E(A)��E(B)��E(C)��ʾ���ִ����¸÷�Ӧ���)��
���ڴ���A�����²����ͬʱ�䴦��NO2�������¶ȹ�ϵ��ͼb����˵��ͼ��������������С��ԭ��________(������¶ȷ�Χ�ڴ�Ч����ͬ)��

��4�����������ں���NO2��������ˮ�м�����������۵Ķ����̿��������ˮ�ľ������Խ�ϵ缫��Ӧ˵�������̿����Ҫ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����з�Ӧ��ˮ���������淴Ӧʱ��ı仯���Ʒ�����ͼ����
A. CO2(g) + 2NH3(g)![]() CO(NH2)2(s) + H2O(g)�� ��H��0 ,��S��0
CO(NH2)2(s) + H2O(g)�� ��H��0 ,��S��0
B. CO2(g) + H2(g)![]() CO(g) + H2O(g)�� ��H��0����S��0
CO(g) + H2O(g)�� ��H��0����S��0
C. CH3CH2OH (g)![]() CH2��CH2(g) + H2O(g)�� ��H��0����S��0
CH2��CH2(g) + H2O(g)�� ��H��0����S��0
D. 2C6H5CH2CH3(g) + O2(g)![]() 2 C6H5CH=CH2(g) + 2H2O(g)�� ��H��0����S��0
2 C6H5CH=CH2(g) + 2H2O(g)�� ��H��0����S��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ʵ�������ʵ�������ʵ����۶���ȷ����
ѡ�� | ʵ����� | ʵ������ | ʵ����� |
A | �����£��������ϵμ�Ũ���� | ���������� | ����Ũ�����Ӧ |
B | ����������ͨ����ɫʯ����Һ | �ȱ�����ɫ | �������������������������Ư���� |
C | ���Ȼ�������Һ�еμ�����KBrϡ��Һ | ��ɫ���DZ�Ϊ����ɫ���� | Ksp(AgCl)>Ksp (AgBr) |
D | NaAlO2��Һ�еμ� NaHCO3��Һ | ������ɫ���� | N aAlO2��Na HCO3������ٽ���ˮ�ⷴӦ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ����һ�ֿɳ��ġ��ɵ�ء���ʹ����������10��15�ꡣ�����ӵ�ص��ܷ�ӦΪCd��2NiOOH��2H2O![]() 2Ni(OH)2��Cd(OH)2������˵������ȷ���ǣ� ��
2Ni(OH)2��Cd(OH)2������˵������ȷ���ǣ� ��
A. �ŵ�ʱ������������������Ӧ����ӦΪCd��2OH����2e��===Cd(OH)2
B. ���ʱ��������ӦΪNi(OH)2(s)��e����OH��(aq)===NiOOH(s)��H2O(l)
C. ��ع���ʱ��������pH����������pH��С
D. �õ�س��ʱ������ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��������̶����ܱ������У�������ӦA(g)+3B(g)![]() 2C(g)����ʼ����1 mol A��3 mol B����ƽ����ٳ���2 mol C����ƽ��
2C(g)����ʼ����1 mol A��3 mol B����ƽ����ٳ���2 mol C����ƽ��
A. �����ƶ� B. �����ƶ�
C. ���ƶ� D. �ٴδ���ƽ��ʱ��C�����������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL 0.1 mol��L-1��HR��Һ����ε���0.1 mol��L-1��NH3��H2O��Һ��������ҺpH�������Ա仯��ͼ�����з�������ȷ����
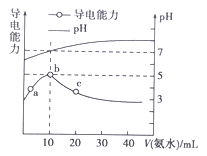
A. b����ҺpH=5����ʱ���ǡ���к�
B. a��b�㵼��������ǿ��˵��HRΪ����
C. c����Һ����c(NH4+)>c(R-)��c(OH-)>c(H+)
D. b��c�������Һ����c(H+)��c(OH-)=Kw=1.0��10-14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĺ�����������______���ṹ��ʽΪ______������Ĺ�����������______���ṹ��ʽΪ_______��������һ�������·�����Ӧ��������______��д��������Ҵ���Ӧ�Ļ�ѧ����ʽ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ҩƷ�ı���˵���������
A.ˮ�����ɱ����ڴ��������IJ���ƿ��
B.�Ʊ�����ú����
C.Һ�ȿ��Ա����ƿ��
D.�������ơ�Ư��Ҫ�ܷⱣ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com