
【题目】t ℃,体积固定的密闭容器中,发生反应A(g)+3B(g)![]() 2C(g),开始充入1 mol A和3 mol B,达平衡后再充入2 mol C,则平衡
2C(g),开始充入1 mol A和3 mol B,达平衡后再充入2 mol C,则平衡
A. 正向移动 B. 逆向移动
C. 不移动 D. 再次达新平衡时,C的体积分数减小
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3+S+5H2O![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6gNa2SO3于100mL烧杯中,加50mL去离子水搅拌溶解。
②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中,_________________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为__________________________。
(4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/LI2的标准溶液滴定,反应的离子方程式为:2S2O32-+I2=S4O62-+2I-,记录数据如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.30 | 21.32 |
2 | 0.36 | 22.56 |
3 | 0.10 | 21.08 |
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2 氧化为SO42-,该反应的离子方程式为 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给150mL某液体加热的操作中,所需的仪器是( )
①试管 ②烧杯 ③酒精灯 ④试管夹 ⑤石棉网 ⑥泥三角 ⑦坩埚 ⑧铁三脚架
A.③⑥⑦⑧B.②③⑤⑧C.①③④⑤D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解,回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和_________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
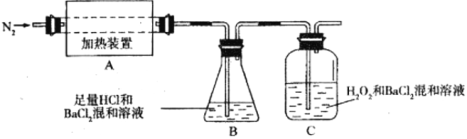
①为验证A中残留物是否含有FeO,需要选用的试剂有_________。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有_________气体生成,若含有该气体,观察到的现象为___________________。
③若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b_________a(填“大于”、“小于”或“等于”)
④实验中,观察到C中有白色沉淀生成,则C中发生反应的离子方程式为________________。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的含量,某实验小组做了如下实验:MnO4-+Fe2++H+=Mn2++Fe3++H2O(方程式未配平)
测定步骤:
步骤一:准确称量20.00g硫酸亚铁铵晶体,配制成100mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.1000mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00mL。
①步骤二达到滴定终点的标志为________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min
D. 当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,相关说法正确的是
A. 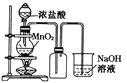 如果MnO2过量,浓盐酸就可全部被消耗
如果MnO2过量,浓盐酸就可全部被消耗
B. 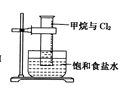 量筒中发生了取代反应
量筒中发生了取代反应
C. 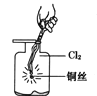 生成蓝色的烟
生成蓝色的烟
D. 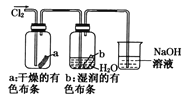 湿润的有色布条褪色说明了Cl2具有漂白性
湿润的有色布条褪色说明了Cl2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列状态的氯中,电离最外层一个电子所需能量最大的是( )
A.[Ne]3s1B.[Ne]3s23p5C.[Ne]3s23p3D.[Ne]3s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com