
【题目】镍—镉电池是一种可充电的“干电池”,使用寿命长达10~15年。镍—镉电池的总反应为Cd+2NiOOH+2H2O![]() 2Ni(OH)2+Cd(OH)2。下列说法不正确的是( )
2Ni(OH)2+Cd(OH)2。下列说法不正确的是( )
A. 放电时,负极发生了氧化反应,反应为Cd+2OH--2e-===Cd(OH)2
B. 充电时,阳极反应为Ni(OH)2(s)-e-+OH-(aq)===NiOOH(s)+H2O(l)
C. 电池工作时,负极区pH增大,正极区pH减小
D. 该电池充电时将电能转化为化学能
【答案】C
【解析】
镍—镉电池的总反应为Cd+2NiOOH+2H2O![]() 2Ni(OH)2+Cd(OH)2,镍镉电池放电时Cd失电子,作负极,反应式为:Cd+2OH--2e-═Cd(OH)2;放电时NiOOH得电子,作正极,反应式为:NiOOH(s)+H2O+e-=Ni(OH)2(s)+OH-,充电时阴极、阳极反应分别与负极、正极反应相反。
2Ni(OH)2+Cd(OH)2,镍镉电池放电时Cd失电子,作负极,反应式为:Cd+2OH--2e-═Cd(OH)2;放电时NiOOH得电子,作正极,反应式为:NiOOH(s)+H2O+e-=Ni(OH)2(s)+OH-,充电时阴极、阳极反应分别与负极、正极反应相反。
A.由分析可知,放电时,负极发生了氧化反应,反应为Cd+2OH--2e-===Cd(OH)2,故A正确;
B.充电时阳极反应分别与正极反应相反。放电时NiOOH得电子,作正极,反应式为:NiOOH(s)+H2O+e-=Ni(OH)2(s)+OH-,充电时,阳极反应为Ni(OH)2(s)-e-+OH-(aq)===NiOOH(s)+H2O(l),故B正确;
C.放电时Cd失电子,作负极,反应式为:Cd+2OH--2e-═Cd(OH)2,NiO(OH)得电子作正极,反应式为:NiOOH(s)+H2O+e-=Ni(OH)2(s)+OH-,所以负极区pH减小,正极区pH增大,故C错误;
D.充电时,作为电解池,将电能转化为化学能,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是( )
A. 生成的乙酸乙酯中含有18OB. 生成的水分子中含有18O
C. 可能生成44 g乙酸乙酯D. 不可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g) + O2(g)![]() 2SO3(g) + 190 kJ
2SO3(g) + 190 kJ
(1)该反应的平衡常数表达式K =___________,该反应450℃时的平衡常数_________500℃时的平衡常数(填“>”“<”或“=”)。
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2) =____________mol/(L·min)
(3)请写出提高SO2转化率的两种方法__________________、___________________。
(4)根据反应方程式,请在图中,绘制反应方向箭头,并在合适位置标明物质与热量 ___________。
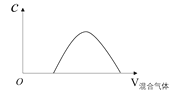
(5)将SO2与SO3的混合气体持续通入一定量的NaOH溶液中,产物中某离子的物质的量浓度与通入气体的体积有如图所示关系,该离子是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中:2A(g)+B(g)![]() 2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
A. 3.4 mol B. 3.2 mol C. 2.8 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解,回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和_________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
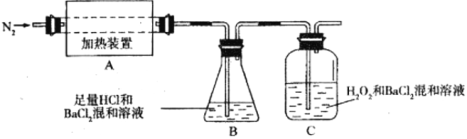
①为验证A中残留物是否含有FeO,需要选用的试剂有_________。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有_________气体生成,若含有该气体,观察到的现象为___________________。
③若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b_________a(填“大于”、“小于”或“等于”)
④实验中,观察到C中有白色沉淀生成,则C中发生反应的离子方程式为________________。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的含量,某实验小组做了如下实验:MnO4-+Fe2++H+=Mn2++Fe3++H2O(方程式未配平)
测定步骤:
步骤一:准确称量20.00g硫酸亚铁铵晶体,配制成100mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.1000mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00mL。
①步骤二达到滴定终点的标志为________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:2Zn+2OH--2e-===2ZnO+H2↑,Ag2O+H2O+2e === 2Ag+2OH- 。据此判断锌是( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生反应并达到平衡:3X(g) + Y(g)![]() 2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的2/3,则下列叙述正确的是
2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的2/3,则下列叙述正确的是
A. 若以X表示的反应速率为0.2 mol/(L·s),则以Z表示的反应速率为0.3 mol/(L·s)
B. 充入氦气增大容器内的压强,Y的转化率提高
C. 升高温度,平衡向正反应方向移动
D. 起始时刻n(X) : n(Y)= 2 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是
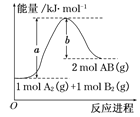
A. 每生成2分子AB吸收b kJ热量
B. 该反应热ΔH=+(a-b) kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com