
【题目】常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
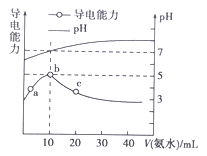
A. b点溶液pH=5,此时酸碱恰好中和
B. a~b点导电能力增强,说明HR为弱酸
C. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于反应:I2(g)+H2(g)2HI(g),在密闭容器中进行,下列条件能加快化学反应速率的是( )
A.缩小体积使压强增大B.体积不变充入He使气体压强增大
C.体积不变使压强减小D.使总压强不变,充入Ne
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解,回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和_________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
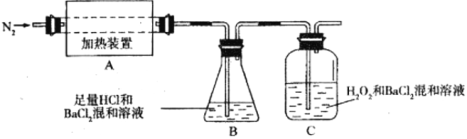
①为验证A中残留物是否含有FeO,需要选用的试剂有_________。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有_________气体生成,若含有该气体,观察到的现象为___________________。
③若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b_________a(填“大于”、“小于”或“等于”)
④实验中,观察到C中有白色沉淀生成,则C中发生反应的离子方程式为________________。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的含量,某实验小组做了如下实验:MnO4-+Fe2++H+=Mn2++Fe3++H2O(方程式未配平)
测定步骤:
步骤一:准确称量20.00g硫酸亚铁铵晶体,配制成100mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.1000mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00mL。
①步骤二达到滴定终点的标志为________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:2Zn+2OH--2e-===2ZnO+H2↑,Ag2O+H2O+2e === 2Ag+2OH- 。据此判断锌是( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min
D. 当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生反应并达到平衡:3X(g) + Y(g)![]() 2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的2/3,则下列叙述正确的是
2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的2/3,则下列叙述正确的是
A. 若以X表示的反应速率为0.2 mol/(L·s),则以Z表示的反应速率为0.3 mol/(L·s)
B. 充入氦气增大容器内的压强,Y的转化率提高
C. 升高温度,平衡向正反应方向移动
D. 起始时刻n(X) : n(Y)= 2 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.H+、Fe2+、SO42-、NO3-B.Fe3+、NH4+、Cl-、SCN-
C.NH4+、Al3+、OH-、SO42-D.Na+、K+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)

A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D. 当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com