
【题目】某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是( )
A.此混合气体中可能含有乙烷
B.此气体中一定含有甲烷
C.此混合气体中一定不含有丙烷
D.此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,A元素所在的周期数、主族序数和原子序数均相等;B原子的最外层电子数是次外层电子数的3倍;C是第三周期原子半径最大的元素;D的单质工业上用于制漂白粉,也用于自来水的消毒.用元素符号或化学式回答下列问题:
(1)C元素在周期表中的位置 , D的单质与水反应的离子方程式为 .
(2)C的离子结构示意图为 , A、B、C形成的化合物的电子式为 .
(3)B、C形成的化合物可用作供氧剂,写出供氧时发生的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2 , Fe(OH)2进一步被氧气氧化为Fe(OH)3 , 再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( ) 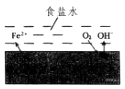
A.铁片发生还原反应而被腐蚀
B.此过程中电子从C移向Fe
C.铁片腐蚀中负极发生的电极反应:2H2O+O2+4e﹣═4OH﹣
D.铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示:
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是( )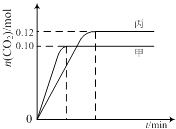
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2 , 则反应达到新平衡前v(正)<v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2 , 则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氦原子电子云图的说法正确的是( )
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大小,表示单位体积内电子出现的机会多少
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气的主要成分是CH4 , 甲烷燃烧时的能量变化如图所示,已知每摩尔水由气态变为液态时放出44kJ的能量.请回答下述问题: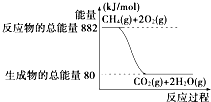
(1)甲烷燃烧生成液态水的热化学方程式为 .
(2)8gCH4完全燃烧时生成液态水放出的热量是kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①碘的饱和水溶液 ②汽油和氯化钠溶液 ③碳酸钙和水。分离以上各混合液的正确方法依次是
A. 萃取、分液、过滤 B. 萃取、分液、蒸馏
C. 分液、蒸馏、过滤 D. 蒸馏、萃取、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态化合物X含C、H、O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量,欲确定化合物X的分子式,所需的最少条件是
A. ①②④ B. ②③④ C. ①③⑤ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钡(BaI22H2O)是一种白色粉末,常用于制取其他含碘化合物.一种制备流程如图1: 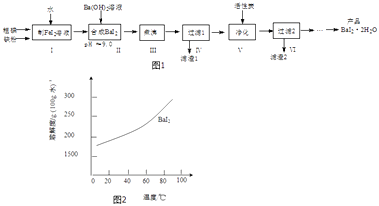
(1)步骤Ⅰ制FeI2溶液时,提高反应速率的可行措施有(填序号).
a.铁粉和碘粉用球磨机磨成细粉
b.增大n(铁粉):n(碘)的配料比
c.适当升高反应温度和搅拌速度
d.向反应器中加水至I2全部溶解
(2)步骤Ⅱ发生反应的化学方程式为;用pH试纸测定溶液pH的方法是
(3)步骤Ⅲ小心“煮沸”约20分钟,可使Fe(OH)2颗粒长大,其目的是;步骤V加入活性炭的目的是 .
(4)从过滤2所得滤液中获得BaI22H2O(溶解度曲线如图2所示)的方法是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com