
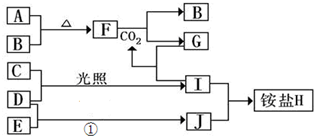
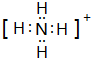 ,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,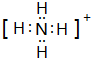 ;取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
;取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、常温下,CH3COONa和CH3COOH混合溶液pH=7,且c(Na+)=0.1mol?L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、在0.1mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2mol?L-1 NaHCO3溶液中加入等体积0.1mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、在0.1mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和乙烯都能与氢气发生加成反应 |
| B、淀粉和蛋白质都是人体重要的营养物质 |
| C、乙酸和乙醇都能与氢氧化钠溶液反应 |
| D、乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
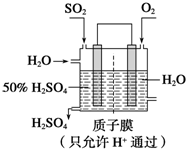
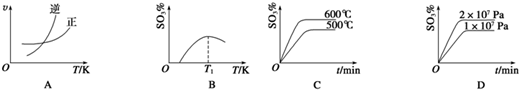
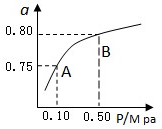
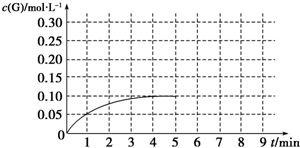
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
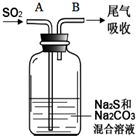 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途.| 资料:25℃时 | |
| H2CO3 | Ki1=4.4×10-7 |
| H2S | Ki1=1.3×10-7 |
| H2SO3 | Ki1=1.54×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
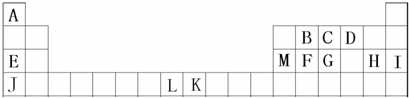
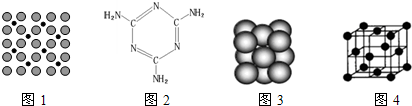
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com