
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对进性的可逆调控.如图,下列说法正确的是( )

A. 该电池可以用NaOH溶液为电解质溶液
B. 放电时电池正极的电极反应式为Fe2O3+6Li++6e-═3Li2O+2Fe
C. 充电时,Fe作为阴极,电池不被磁铁吸引
D. 磁铁的主要成分是Fe3O4,其既可吸引铁,也可吸引Fe2O3
科目:高中化学 来源: 题型:
【题目】下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
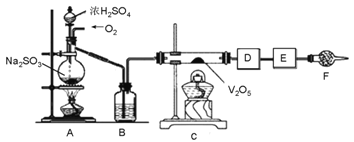
完成下列填空:
(1).A处的化学反应方程式为__________________,仪器F的名称为___________________________。
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________,E:______________。

(3).用amolNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间O2,最后测得E处装置增重bg,则此时SO2的转化率为_____%(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3.4gNH3中含有的氢原子数为0.6NAB.0.5mol/LNa2CO3溶液中含有的Na+数为NA
C.标准状况下,11.2LH2O含有的原子数为1.5NAD.常温常压下,22.4L臭氧所含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4 ℃下,把质量A g摩尔质量为M g·mol-1的可溶性盐RCln 溶解在V mL水中,恰好形成该温度下的饱和溶液,密度为ρ g·cm-3,下列关系式错误的是
A. 溶质的质量分数ω=A/(A+V)×100%
B. 溶质的物质的量浓度c=1 000ρ A/(MA+MV) mol·L-1
C. 该温度下此盐的溶解度S=100A/V g
D. 1 mL该溶液中n(Cl-)=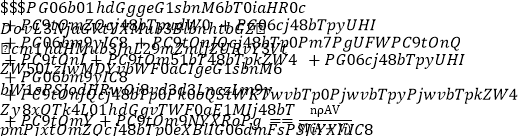 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶盐融化。已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )
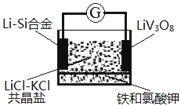
A. 整个过程的能量转化只涉及化学能转化为电能
B. 放电时LiV3O8一极反应为:Li1+xV3O8-xe═LiV3O8+xLi+
C. 外电路中有NA个电子发生转移时,有7.0gLi+移向Li-Si合金一极
D. Li-Si合金熔点高于352℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用混有硫酸亚铁和硫酸镁等杂质的锰矿(含MnO2、MnCO3)生产硫酸锰,实验室模拟生产过程如下:
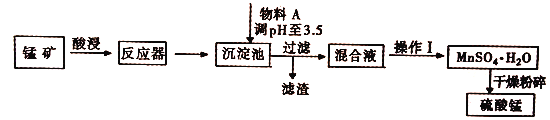
(完全沉淀离子的pH值:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6)
(1)酸浸中加入的酸是________(填化学式,下同),提高酸浸速率的方法是____(任写一种),从经济效益考虑,物料A可能是___________。
(2)反应器中发生氧化还原反应的离子方程式是___________________ 。
(3)硫酸锰和硫酸镁的溶解度曲线如图所示:
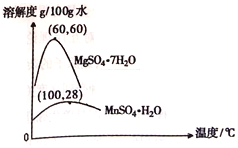
①操作I为:在_____℃下蒸发结晶、趁热过滤。其趁热过滤目的是__________;
②为了得到更纯净的一水合硫酸锰,需将晶体置于过滤器中,用_____进行洗涤(本空格从以下选择)
a.蒸馏水 b.稀硫酸 c.饱和硫酸锰溶液 d.氢氧化钠溶液
(4)MnSO4·H2O在1150℃高温下易分解,产物是Mn304、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酶指具有生物催化功能的高分子物质.在酶的催化反应体系中,反应物分子被称为底物,底物通过酶的催化转化为其他分子.几乎所有的细胞活动进程都需要酶的参与,以提高效率.请回答下列问题:
(1)酶氧化酶与酚类底物在细胞中能实现分类存放,是因为细胞内具有 系统,组成该系统的结构具有的功能特性是 .茶叶细胞中也存在众多种类的酚类物质与酚氧化酶.绿茶制取过程中必须先进行热锅高温炒制,这一过程的目的是 .
(2)茶树的Rubicon酶在CO2浓度较高时,该酶催化C2与CO2反应,Rubicon酶的存在场所为 ;该酶具有“两面性”,在O2浓度较高时,该酶催化C2与O2反应,产物经一系列变化后到线粒体中会产生CO2,其“两面性”与酶的 (特性)相矛盾.
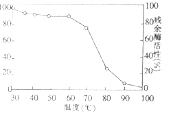
(3)如图中曲线表示将酶在不同温度下保温足够长时间,再在酶活性最高的温度下测其残余酶活性,由图可得出: .为了验证这一结论,请以耐高温的纤维素分解酶为实验材料,比较在低温和最适温度下储存对酶活性的影响,写出实验设计思路: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com