
【题目】对相同质量的丙烯和乙烯的下列叙述中,错误的是
A. 碳原子个数比为1∶1B. 分子个数比为2∶3
C. 氢原子个数比为1∶1D. 分子个数比为3∶2
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
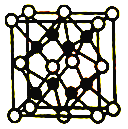
【题目】X、Y、Z、W、R五种前四周期元素,原子序数依次增大,其中X原基态时最外层电子数是其内层电子总数的2倍,Z原子基态时s电子数与p电子数相等,Z2-和W+有相同的核外电子排布;R的原子序数为29。回答下列问题:
(1)Y、Z、W三种元素的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)若M分子是Y2Z的等电子体,M的结构式为______, M分子的中心原子的轨道杂化类型为________, 1molM中含有_____molσ键。
(3)Y的简单氢化物极易溶于Z的简单氢化物中,其主要原因是_____________。
(4)基态R+离子的核外电子排布式是__________,R的高价离子与Y的最常见氢化物形成的配离子的化学式为________________。
(5)Z与W形成的化合物W2Z的晶胞如图。其中Z离子的配位数为________,与一个Z离子距离最近的所有W离子为顶点构成的几何体为________结构。若W2Z的晶胞边长为a pm,则该化合物的密度为_______g·cm-3(列出计算式即可,阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质。(反应过程中生成的水及其他产物已略去)。请回答下列问题:
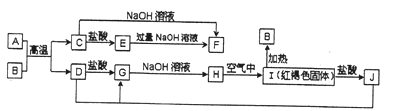
(1)B的化学式为_______________。
(2)K的电子式为_________________。
(3)写出J与D反应转化为G的离子方程式___________________。
(4)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物。m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01 mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法不正确的是( )
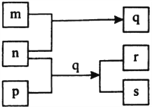
A. 原子半径的大小W<X<Z
B. W的氧化物常温常压下为液态
C. Y的氧化物可能呈黑色或红棕色
D. Z的氧化物的水化物一定为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______

(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与稀盐酸混合所得的体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
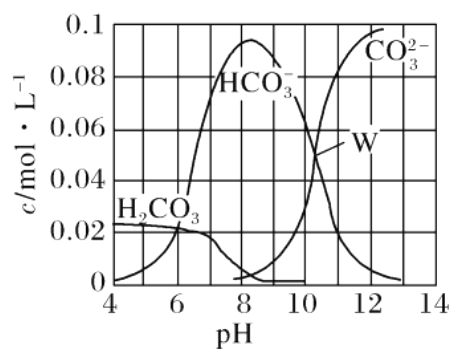
A. W点所示的溶液:c(Na+)>c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. pH=4的溶液:c(H2CO3)+c(HCO![]() )+c(CO
)+c(CO![]() )=0.1 mol·L-1
)=0.1 mol·L-1
C. 向pH=8的溶液中通入CO2至pH=7所得的溶液:c(Na+)>c(Cl-)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D. pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 向NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO![]() +Ba2++2OH-===BaCO3↓+2H2O+CO
+Ba2++2OH-===BaCO3↓+2H2O+CO![]()
B. 用铁电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO![]() +CO2+H2O===2NaHCO3↓
+CO2+H2O===2NaHCO3↓
D. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3 ·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同
B. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
C. 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D. 已知I![]()
![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂,且催化性能相当)。
结 构 简 式 |
|
|
|
键 线 式 |
|
|
|
①![]()
②![]()
③![]()
④![]() (未配平)
(未配平)
回答下列问题:
(1)1,4-丁二醇(HOCH2CH2CH2CH2OH)的键线式可以表示为_______________
咔唑( )的分子式为__________________。
)的分子式为__________________。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是_____________(填名称)。判断的依据为____________________。
(3)写出鉴别环丙烷和丙烯的一种方法。试剂__________;现象与结论__________。
(4)已知某烯烃在酸性高锰酸钾的作用下只产生一种有机物C3H6O,其产物物质的量是原烯烃的两倍且其氢核磁共振谱图只有一个峰。根据题给信息判断该烯烃的结构简式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com