
【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______

(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。
【答案】 bdef 防止硝酸银见光分解 0.508%或0.51% H2O2+I-=H2O+IO- H2O2+IO-=H2O+O2↑+I- 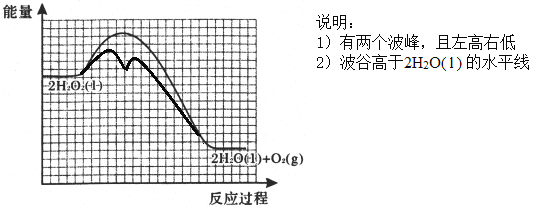 室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性 加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性
室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性 加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性
【解析】(1)①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是三脚架、泥三角、酒精灯、坩埚钳,答案选 bdef;②防止硝酸银见光分解,所以使用棕色滴定管;③根据表中数据可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×500mL/100mL=0.001mol,说明25.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:127g/mol×0.001mol/25.00g×100%=0.508%;(2)①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,则第一步消耗碘离子,第二步又产生碘离子,依次发生反应的离子方程式为H2O2+I-=H2O+IO-、H2O2+IO-=H2O+O2↑+I-;②由于催化剂降低反应的活化能,但不能改变焓变。又因为反应甲为吸热反应,且甲的反应速率小于乙的反应速率,所以反应过程的能量变化图为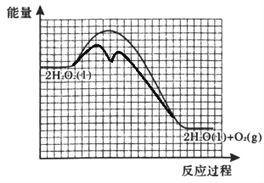 。(3)①如果HI是强酸,则KI不水解,溶液显碱性,因此证明是强酸的实验为:室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性;②如果HI不稳定,则受热分解生成碘蒸气,碘蒸气是紫色,则证明不稳定的实验为:加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性。
。(3)①如果HI是强酸,则KI不水解,溶液显碱性,因此证明是强酸的实验为:室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性;②如果HI不稳定,则受热分解生成碘蒸气,碘蒸气是紫色,则证明不稳定的实验为:加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为:![]() ,易溶于水,下列说法正确的是( )
,易溶于水,下列说法正确的是( )
A. 1 mol苹果酸可与3 mol NaOH发生中和反应
B. 苹果酸的一种缩聚产物是![]()
C. 含1 mol苹果酸的稀溶液与足量金属Na反应生成1.5 mol H2
D. 苹果酸的催化氧化产物能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A. 单质:生铁、赤铜、青铜
B. 有机物:甲烷、葡萄糖、乙醇
C. 纯净物:冰水混合物、纯碱、98%浓硫酸
D. 氧化物:双氧水、生石灰、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是

A. 该反应的化学方程式为5A+4B![]() 4C
4C
B. 2min前,正反应速率逐渐减小,逆反应速率逐渐增大
C. 用B的浓度变化表示2min内的速率为2mol/(L·min)
D. 2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
2SO3(g) △H<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )

A. t2时改变的条件是:只加入一定量的SO2
B. 在t1时平衡常数K1大于t3时平衡常数K2
C. t1时平衡混合气的![]() 大于t3时平衡混合气的
大于t3时平衡混合气的![]()
D. t1时平衡混合气中SO3的体积分数等于t3时平衡混合气中SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对相同质量的丙烯和乙烯的下列叙述中,错误的是
A. 碳原子个数比为1∶1B. 分子个数比为2∶3
C. 氢原子个数比为1∶1D. 分子个数比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. IA族与VIIA族元素间可形成共价化合物或离子化合物
B. 共价键只存在于共价化合物中
C. 使阴阳离子结合形成化合物的静电作用,叫做离子键
D. 含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)肉桂酸甲酯G是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,用芳香烃A为原料合成肉桂酸甲酯G的路线如下:
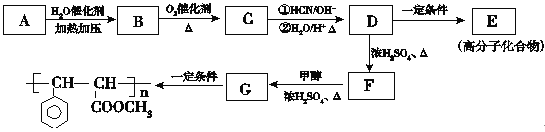
已知: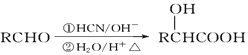
(1)B的官能团的名称________。
(2)D→F的反应类型是________。
(3)肉桂酸甲酯的结构简式为_________。
(4)写出A的结构简式___________。
(5)C与银氨溶液反应的化学方程式________。
(6)D转化为E的化学方程式_________。
(7)写出![]() 与足量氢氧化钠溶液反应的化学方程式________。
与足量氢氧化钠溶液反应的化学方程式________。
(8)写出符合下列条件的D的同分异构体的结构简式_______。
①苯环上有两个取代基且苯环上的一氯代物有两种;
②遇FeCl3溶液显紫色
③在NaOH溶液中反应最多能消耗3mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,金属片紧贴着滤纸,下列判断错误的是( )
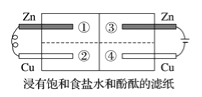
A. 左侧锌片是负极,右侧锌片是阳极 B. 左侧铜片上的电极反应为2H++2e-=H2↑
C. 阴离子移动方向分别由②→①、③→④ D. 左侧变红色的区域是②、右侧变红色的区域是④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com