
【题目】如图所示的装置中,金属片紧贴着滤纸,下列判断错误的是( )
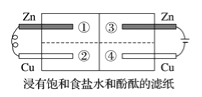
A. 左侧锌片是负极,右侧锌片是阳极 B. 左侧铜片上的电极反应为2H++2e-=H2↑
C. 阴离子移动方向分别由②→①、③→④ D. 左侧变红色的区域是②、右侧变红色的区域是④
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______

(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~ 100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质说法正确的是
①是浊液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸
⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A. ① ⑤⑥ B. ②③④ C.②③⑤ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A. 生成1 molHF气体放出的热量为270 kJ
B. H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C. 反应物的总能量大于生成物的总能量
D. 该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上绝大部分卤素都存在于海洋。海水呈微碱性,海水晒盐可以得到粗盐和卤水,对粗盐和卤水进一步加工可以得到氯气、溴以及其他一些重要的化工产品。
完成下列填空:
(1)工业上用电解饱和食盐水的方法获取氯气。写出阴极的电极反应式_______________,该反应为________(选填“氧化”、“还原”)反应。若转移5mol电子,生成氯气______L(标准状况下)。
(2)工业上从卤水获取溴,涉及到“氧化”、“提取”等步骤。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是________________。在“提取”过程中,用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-和BrO3-,同时有CO2生成,写出反应的化学方程式________________________________。
(3)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_____________。
(4)足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂,且催化性能相当)。
结 构 简 式 |
|
|
|
键 线 式 |
|
|
|
①![]()
②![]()
③![]()
④![]() (未配平)
(未配平)
回答下列问题:
(1)1,4-丁二醇(HOCH2CH2CH2CH2OH)的键线式可以表示为_______________
咔唑( )的分子式为__________________。
)的分子式为__________________。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是_____________(填名称)。判断的依据为____________________。
(3)写出鉴别环丙烷和丙烯的一种方法。试剂__________;现象与结论__________。
(4)已知某烯烃在酸性高锰酸钾的作用下只产生一种有机物C3H6O,其产物物质的量是原烯烃的两倍且其氢核磁共振谱图只有一个峰。根据题给信息判断该烯烃的结构简式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
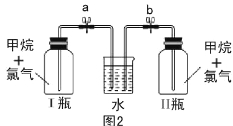
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。
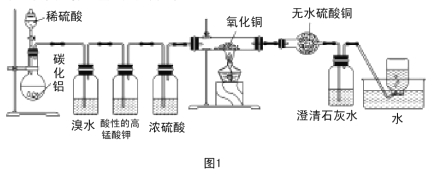
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为 。
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 (实验测得消耗甲烷与氧化铜物质的量之比2∶7)。
(3)实验甲中浓硫酸的作用是 ,集气瓶中收集到的气体 (填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是( )
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 。除了上述现象外,该实验中还可能观察到的现象有 (填序号)。
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林是一种治疗心脑血管疾病的药物,可由化合物E和M 在一定条件下合成得到(部分反应条件略)。

请回答下列问题:
(1)A的名称为________,A→B的反应类型为________。
(2)E的分子式是_______。D→E的反应中,加入的化合物X与新制Cu(OH)2反应产生红色沉淀的化学方程式为______________。
(3)G→J为取代反应,其另一产物分子中的官能团名称是________。1molG完全燃烧最少需要消耗______mo1O2。
(4)L的同分异构体Q 是芳香酸, ![]() ,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是________,写出能检验该物质存在的显色反应中所用的试剂及实验现象_______________________。
(6)已知:L→M的原理为:①
②
M的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔触的金属锡在300℃左右能直接与氯气作用生成四氯化锡。四氯化锡的熔点-33℃,沸点114℃,遇潮湿空气水解。某学习小组用以下装置制取少量四氯化锡。回答下列问题:
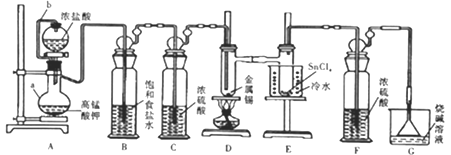
(1)仪器组装完毕,为检查装置的气密性,将装置G中漏斗改为导管且管口浸没于水中,后续操作是__________,说明气密性良好。
(2)仪器a的名称是__________;设计连接管b的目的是_______________。
(3)装置B、F的作用分別是______________、____________。
(4)装置A中反应的离子方程式为______________,排尽装置中的空气后才能点燃D处的酒精灯,判断装置中的空气已排尽的现象是_____________;D中加热的作用之一是加快氯气与金属锡反应,另一作用是__________。
(5)四氯化锡遇潮湿空气时有白色烟雾产生,同时生成白色固体(SnO2·xH2O),该反应的化学方程式为_____________。
(6)实验结束后,若制得SnCl4的质量为2.61g,Cl2的转化率为80%,则消耗KmnO4的质量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com