
【题目】华法林是一种治疗心脑血管疾病的药物,可由化合物E和M 在一定条件下合成得到(部分反应条件略)。

请回答下列问题:
(1)A的名称为________,A→B的反应类型为________。
(2)E的分子式是_______。D→E的反应中,加入的化合物X与新制Cu(OH)2反应产生红色沉淀的化学方程式为______________。
(3)G→J为取代反应,其另一产物分子中的官能团名称是________。1molG完全燃烧最少需要消耗______mo1O2。
(4)L的同分异构体Q 是芳香酸, ![]() ,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是________,写出能检验该物质存在的显色反应中所用的试剂及实验现象_______________________。
(6)已知:L→M的原理为:①
②
M的结构简式为__________。
【答案】 丙炔 加成反应 C10H10O C6H5CHO+2Cu(OH)2+NaOH![]() C6H5COONa+Cu2O↓+3H2O 羧基 4
C6H5COONa+Cu2O↓+3H2O 羧基 4 ![]()
![]() 苯酚 FeCl3溶液 溶液呈紫色(
苯酚 FeCl3溶液 溶液呈紫色( 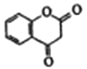
【解析】(1)A中含有碳碳三键,属于炔烃,为丙炔,故可知A→B是丙炔与H2O发生加成反应;(2)根据E的结构简式可知分子式为C10H10O。利用D、E的结构简式知E是D与X(苯甲醛)发生反应生成E与H2O,苯甲醛可与新制氢氧化铜浊液发生氧化还原反应生成苯甲酸与砖红色氧化亚铜沉淀、水,反应溶液为碱性,因此生成苯甲酸又与碱反应生成苯甲酸盐,由此可知苯甲醛与新制氢氧化铜浊液反应的化学方程式为:C6H5CHO+2Cu(OH)2+NaOH![]() C6H5COONa+Cu2O↓+3H2O;(3)G为乙酸酐,G与苯酚生成J同时,还生成乙酸,乙酸中含有的官能团是-COOH;根据醋酸酐的结构简式可知1molG完全燃烧最少需要消耗(4+6/4-3/2)=4mo1O2。(4)Q→R是苯环上的甲基上的1个H原子被取代,R→S是氯代烃的水解反应,S→T是-CH2OH变成-COOH,T的核磁共振氢谱只有两组峰,说明2个羧基处在苯环的对位,Q为对甲基苯甲酸,Q结构简式为
C6H5COONa+Cu2O↓+3H2O;(3)G为乙酸酐,G与苯酚生成J同时,还生成乙酸,乙酸中含有的官能团是-COOH;根据醋酸酐的结构简式可知1molG完全燃烧最少需要消耗(4+6/4-3/2)=4mo1O2。(4)Q→R是苯环上的甲基上的1个H原子被取代,R→S是氯代烃的水解反应,S→T是-CH2OH变成-COOH,T的核磁共振氢谱只有两组峰,说明2个羧基处在苯环的对位,Q为对甲基苯甲酸,Q结构简式为![]() ,R为
,R为![]() ,则R→S的化学方程式为:
,则R→S的化学方程式为:
![]() ;(5)苯酚可与甲醛缩合成体型高分子化合物,检验酚羟基一般用氯化铁溶液,实验现象是溶液显紫色;(6)L→M是取代反应,由①的反应信息,-OH与C2H5OCOOC2H5反应,-COOC2H5与酚羟基H原子交换,由②的反应信息可知,发生自身交换生成M,故M的结构简式为:
;(5)苯酚可与甲醛缩合成体型高分子化合物,检验酚羟基一般用氯化铁溶液,实验现象是溶液显紫色;(6)L→M是取代反应,由①的反应信息,-OH与C2H5OCOOC2H5反应,-COOC2H5与酚羟基H原子交换,由②的反应信息可知,发生自身交换生成M,故M的结构简式为: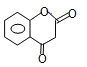 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(16分)肉桂酸甲酯G是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,用芳香烃A为原料合成肉桂酸甲酯G的路线如下:
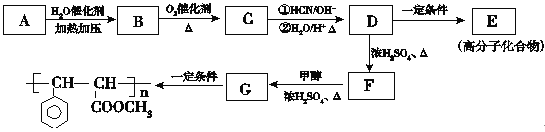
已知: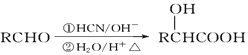
(1)B的官能团的名称________。
(2)D→F的反应类型是________。
(3)肉桂酸甲酯的结构简式为_________。
(4)写出A的结构简式___________。
(5)C与银氨溶液反应的化学方程式________。
(6)D转化为E的化学方程式_________。
(7)写出![]() 与足量氢氧化钠溶液反应的化学方程式________。
与足量氢氧化钠溶液反应的化学方程式________。
(8)写出符合下列条件的D的同分异构体的结构简式_______。
①苯环上有两个取代基且苯环上的一氯代物有两种;
②遇FeCl3溶液显紫色
③在NaOH溶液中反应最多能消耗3mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,金属片紧贴着滤纸,下列判断错误的是( )
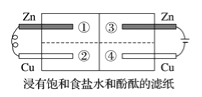
A. 左侧锌片是负极,右侧锌片是阳极 B. 左侧铜片上的电极反应为2H++2e-=H2↑
C. 阴离子移动方向分别由②→①、③→④ D. 左侧变红色的区域是②、右侧变红色的区域是④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10 mol L-1的氨水滴定10.00 mL a mol L-1的盐酸,溶液的pH与氨水的体积(V)的关系如图所示。已知:N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法正确的是
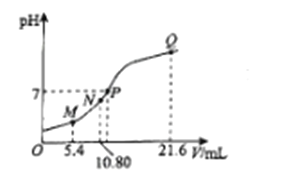
A. M点溶液中存在:c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+)
B. N、Q两点溶液中NH3 H2O的电离常数:N<Q
C. P 点氨水过量,c(NH4+)> c(Cl-)
D. a=0.054
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.苯是一种重要的化工原料,其产品在我们的生活中无处不在。
(1)一定条件下,利用如图所示装置可实现有机物苯(C6H6)到环己烷(C6H12)的转化。
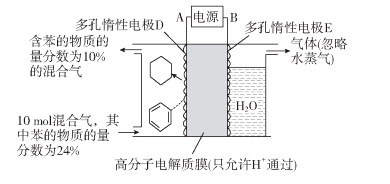
生成目标产物的电极反应式为__________;装置图右侧导出的气体是__________。
(2)已知苯和乙烯可以在催化剂存在的条件下发生加成反应。以苯和乙烯为原料可合成聚苯 乙烯,请设计合成路线(无机试剂及溶剂任选)。合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
_________________________________________________________________________
II.丙烯是三大合成材料的基本原料,用于制丙烯腈、环氧丙烷、丙酮、甘油等。下图是以丙烯为原料合成甘油最重要的生产方法。
CH2=CHCH3 ![]() C3H5Cl
C3H5Cl ![]() C3H6OCl2
C3H6OCl2 ![]()
![]()
![]() 甘油
甘油
(3)①的反应类型是:____________
(4)产物C3H6OCl2有两种,选择一种写出反应③的化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向饱和澄清石灰水中加入一定量的生石灰,充分反应后恢复到原温度,下列有关说法中,正确的是
A. 溶液中Ca2+数目增加 B. 溶液中Ca2+数目减少
C. 溶液中OH-浓度减少 D. 溶液中OH-浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素有多种化合价,可形成多种化合物。 H2S和SO2在工农业生产中具有重要应用。
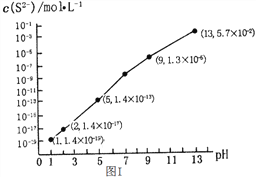
(1)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图I所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol/L;
②某溶液含0.01 mol/LFe2+、未知浓度的Mn2+和0.10 mol/L H2S,当溶液pH=________时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中![]() =____________。
=____________。
【已知:KSP(FeS)=1.4×10-19,KSP(MnS)=2.8×10-13】
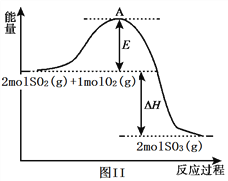
(2) 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+1/2O2(g)![]() SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
①图II中ΔH=____________ kJ/mol;该反应通常用V2O5作催化剂,加V2O5会使图中A点降低,原因是_____________________________________________________ 。
②该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)______ v(逆)(填“<”、“>”或“=”)。
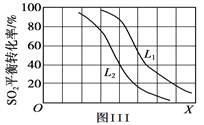
③L(L1、L2)、X可分别代表压强或温度。图III表示L一定时,SO2(g)的平衡转化率随X的变化关系。则X代表的物理量是____________;L1、L2的大小关系为L1_________L2(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对气体或溶液中的离子鉴定方案正确的是
A.向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+
B.向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中含![]()
C.向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含![]()
D.向溶液中加入浓NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中含![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com