
【题目】25℃时,用0.10 mol L-1的氨水滴定10.00 mL a mol L-1的盐酸,溶液的pH与氨水的体积(V)的关系如图所示。已知:N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法正确的是
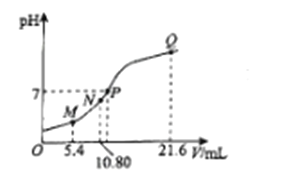
A. M点溶液中存在:c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+)
B. N、Q两点溶液中NH3 H2O的电离常数:N<Q
C. P 点氨水过量,c(NH4+)> c(Cl-)
D. a=0.054
【答案】A
【解析】N点溶液中存在的电荷守恒式为c(H+)+c(NH4+)=c(OH-)+c(Cl-) ,已知c(H+)=c(OH-)+c(NH3·H2O),则c(NH3·H2O)+c(NH4+)=c(Cl-) 可知此时溶液中只有NH4Cl,即滴加氨水10.8mL时恰好完全中和,所得溶液为NH4Cl;A.M点滴加氨水为5.4mL 完全反应后溶液为HCl和NH4Cl等浓度的混合溶液,存在的电荷守恒式为c(H+)+c(NH4+)=c(OH-)+c(Cl-) ,若c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+),则2c(NH3·H2O)+ 2c(NH4+)=c(Cl-) ,满足物料守恒,故A正确;B.NH3 H2O的电离常数只随温度变化而变化,恒温下电离平衡常数不变,即N=Q,故B错误;C.P 点氨水过量,此时溶液显中性,即c(H+)=c(OH-) ,根据电荷守恒式c(H+)+c(NH4+)=c(OH-)+c(Cl-) 可知,c(NH4+)= c(Cl-),故C错误;D.N点恰好完全中和,则0.10 mol L-1×10.8mL=10.00 mL× a mol L-1,a=0.108,故D错误;答案为A。


科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 向NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO![]() +Ba2++2OH-===BaCO3↓+2H2O+CO
+Ba2++2OH-===BaCO3↓+2H2O+CO![]()
B. 用铁电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO![]() +CO2+H2O===2NaHCO3↓
+CO2+H2O===2NaHCO3↓
D. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3 ·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A. 生成1 molHF气体放出的热量为270 kJ
B. H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C. 反应物的总能量大于生成物的总能量
D. 该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂,且催化性能相当)。
结 构 简 式 |
|
|
|
键 线 式 |
|
|
|
①![]()
②![]()
③![]()
④![]() (未配平)
(未配平)
回答下列问题:
(1)1,4-丁二醇(HOCH2CH2CH2CH2OH)的键线式可以表示为_______________
咔唑( )的分子式为__________________。
)的分子式为__________________。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是_____________(填名称)。判断的依据为____________________。
(3)写出鉴别环丙烷和丙烯的一种方法。试剂__________;现象与结论__________。
(4)已知某烯烃在酸性高锰酸钾的作用下只产生一种有机物C3H6O,其产物物质的量是原烯烃的两倍且其氢核磁共振谱图只有一个峰。根据题给信息判断该烯烃的结构简式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
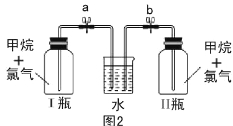
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。
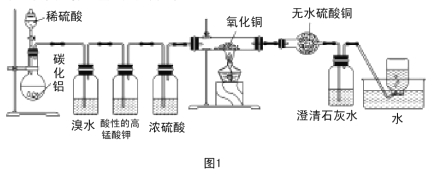
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为 。
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 (实验测得消耗甲烷与氧化铜物质的量之比2∶7)。
(3)实验甲中浓硫酸的作用是 ,集气瓶中收集到的气体 (填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是( )
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 。除了上述现象外,该实验中还可能观察到的现象有 (填序号)。
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国机动车保有量持续增长,汽车尾气排放已成为城市的主要污染源,汽车尾气催化净化成为及其重要的环保产业。回答下列问题:
(1)用活性炭还原法可以处理汽车尾气中氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①第一次达平衡时,NO的转化率为_____________ ,T1℃时,该反应的平衡常数K=_______________。
②30min后只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是___________;
③若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol·L-1,则反应达平衡时c(NO)=________。
④若升高温度为T2℃,该反应是平衡常数K减小,原因是_______________。
(2)在汽车排气管加装催化转换器,可有效降低污染物的浓度。已知,催化转换器的效率计算:
ηi= ![]() ×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
温度/℃ | 流量/(m3·h-1) | CxHy/(106ppm) | CO/% | NOx/(106ppm) | |
入口 | 100 | 0.2 | 139 | 2.66 | 21 |
出口 | 31 | 0 | 0 |
①在上述条件下,η(CO)、η(NOx)均达100%,η(CxHy)=_____________。
②两种不同的催化剂JFG和HPA-8在不同温度、流量下CxHy的去除率如图所示:
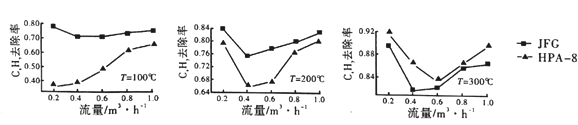
比较两种催化剂在不同温度下对CxHy的转化效率,由此可得出的结论是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林是一种治疗心脑血管疾病的药物,可由化合物E和M 在一定条件下合成得到(部分反应条件略)。

请回答下列问题:
(1)A的名称为________,A→B的反应类型为________。
(2)E的分子式是_______。D→E的反应中,加入的化合物X与新制Cu(OH)2反应产生红色沉淀的化学方程式为______________。
(3)G→J为取代反应,其另一产物分子中的官能团名称是________。1molG完全燃烧最少需要消耗______mo1O2。
(4)L的同分异构体Q 是芳香酸, ![]() ,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是________,写出能检验该物质存在的显色反应中所用的试剂及实验现象_______________________。
(6)已知:L→M的原理为:①
②
M的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.v(A) = 0.7mol·L-1·S-1 B.v(B) = 0.3 mol·L-1·S-1
C.v(C) = 0.8mol·L-1·S-1 D.v(D) = 1 mol·L-1·S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键类型完全相同的是( )
A. CaH2 和 Na2S B. Na2O 和Na2O2
C. CO2 和CaO D. HCl 和NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com