
【题目】氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A. 生成1 molHF气体放出的热量为270 kJ
B. H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C. 反应物的总能量大于生成物的总能量
D. 该反应是吸热反应
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是

A. 该反应的化学方程式为5A+4B![]() 4C
4C
B. 2min前,正反应速率逐渐减小,逆反应速率逐渐增大
C. 用B的浓度变化表示2min内的速率为2mol/(L·min)
D. 2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)肉桂酸甲酯G是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,用芳香烃A为原料合成肉桂酸甲酯G的路线如下:
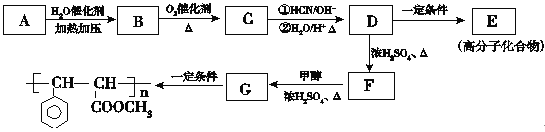
已知: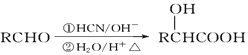
(1)B的官能团的名称________。
(2)D→F的反应类型是________。
(3)肉桂酸甲酯的结构简式为_________。
(4)写出A的结构简式___________。
(5)C与银氨溶液反应的化学方程式________。
(6)D转化为E的化学方程式_________。
(7)写出![]() 与足量氢氧化钠溶液反应的化学方程式________。
与足量氢氧化钠溶液反应的化学方程式________。
(8)写出符合下列条件的D的同分异构体的结构简式_______。
①苯环上有两个取代基且苯环上的一氯代物有两种;
②遇FeCl3溶液显紫色
③在NaOH溶液中反应最多能消耗3mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两元素原子的L层电子数都是其他层电子总数的2倍,甲的原子半径大于乙的原子半径,下列说法正确是( )
A. 甲、乙处于同一周期 B. 它们中有一种元素位于第ⅥA族
C. 乙的最高价氧化物与甲的单质不反应 D. 简单甲离子的电子式为:Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
A. 它是一种共价化合物 B. 在加热时此化合物可以分解为PH3和HI
C. 这种化合物不能跟碱反应 D. 该化合物不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,金属片紧贴着滤纸,下列判断错误的是( )
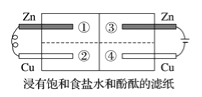
A. 左侧锌片是负极,右侧锌片是阳极 B. 左侧铜片上的电极反应为2H++2e-=H2↑
C. 阴离子移动方向分别由②→①、③→④ D. 左侧变红色的区域是②、右侧变红色的区域是④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10 mol L-1的氨水滴定10.00 mL a mol L-1的盐酸,溶液的pH与氨水的体积(V)的关系如图所示。已知:N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法正确的是
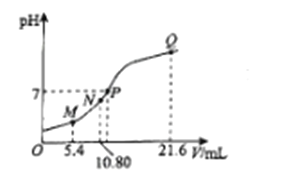
A. M点溶液中存在:c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+)
B. N、Q两点溶液中NH3 H2O的电离常数:N<Q
C. P 点氨水过量,c(NH4+)> c(Cl-)
D. a=0.054
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素有多种化合价,可形成多种化合物。 H2S和SO2在工农业生产中具有重要应用。
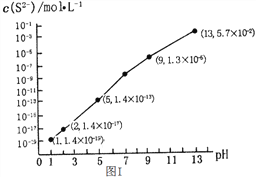
(1)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图I所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol/L;
②某溶液含0.01 mol/LFe2+、未知浓度的Mn2+和0.10 mol/L H2S,当溶液pH=________时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中![]() =____________。
=____________。
【已知:KSP(FeS)=1.4×10-19,KSP(MnS)=2.8×10-13】
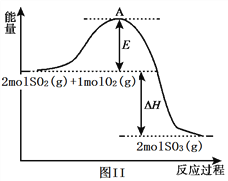
(2) 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+1/2O2(g)![]() SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
①图II中ΔH=____________ kJ/mol;该反应通常用V2O5作催化剂,加V2O5会使图中A点降低,原因是_____________________________________________________ 。
②该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)______ v(逆)(填“<”、“>”或“=”)。
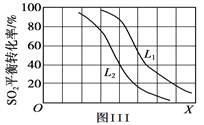
③L(L1、L2)、X可分别代表压强或温度。图III表示L一定时,SO2(g)的平衡转化率随X的变化关系。则X代表的物理量是____________;L1、L2的大小关系为L1_________L2(填“<”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com