
【题目】硫元素有多种化合价,可形成多种化合物。 H2S和SO2在工农业生产中具有重要应用。
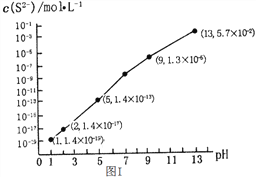
(1)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图I所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol/L;
②某溶液含0.01 mol/LFe2+、未知浓度的Mn2+和0.10 mol/L H2S,当溶液pH=________时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中![]() =____________。
=____________。
【已知:KSP(FeS)=1.4×10-19,KSP(MnS)=2.8×10-13】
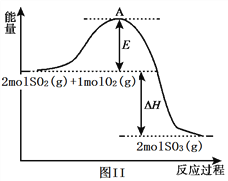
(2) 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+1/2O2(g)![]() SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图II所示。
①图II中ΔH=____________ kJ/mol;该反应通常用V2O5作催化剂,加V2O5会使图中A点降低,原因是_____________________________________________________ 。
②该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)______ v(逆)(填“<”、“>”或“=”)。
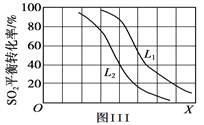
③L(L1、L2)、X可分别代表压强或温度。图III表示L一定时,SO2(g)的平衡转化率随X的变化关系。则X代表的物理量是____________;L1、L2的大小关系为L1_________L2(填“<”、“>”或“=”)。
【答案】 0.043 2 2.0×106 -198 因为催化剂改变了反应历程,使活化能E降低 > 温度 >
【解析】(1)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10molL-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L;②当Qc=Ksp(FeS)时开始沉淀,所以c(S2-)=Ksp(FeS)/c(Fe2+)
=1.4×1019/0.01mol/L=1.4×10-17mol/L,结合图象得出此时的pH=2,所以pH=2时亚铁离子开始沉淀;溶液中c(Mn2+)/c(Fe2+)=Ksp(MnS)/Ksp(FeS)=2.8×1013/1.4×1019mol/L=2×106;(2)SO2(g)+1/2O2(g)SO3(g)△H=-99kJ/mol, ①图象分析可知2molSO2和氧气全部反应,反应焓变△H=-99kJ/mol×2mol=-198kJ;E为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关;加入催化剂改变了反应的途径,降低反应所需的活化能,所以E的变化是减小;②该温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),浓度分别是(mol/L)0.03、0.16、0.03,浓度商Qc=0.03/0.03×0.161/2=2.5<3.33,则反应开始时(正)>v(逆);③由图可知,X越大,转化率越低,该反应正反应为气体体积减小的反应,如果增大压强,二氧化碳的转化率大,所以X表示温度,温度升高,转化率下降,平衡逆向移动,增大压强,转化率大,所以L1>L2。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A. 生成1 molHF气体放出的热量为270 kJ
B. H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C. 反应物的总能量大于生成物的总能量
D. 该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林是一种治疗心脑血管疾病的药物,可由化合物E和M 在一定条件下合成得到(部分反应条件略)。

请回答下列问题:
(1)A的名称为________,A→B的反应类型为________。
(2)E的分子式是_______。D→E的反应中,加入的化合物X与新制Cu(OH)2反应产生红色沉淀的化学方程式为______________。
(3)G→J为取代反应,其另一产物分子中的官能团名称是________。1molG完全燃烧最少需要消耗______mo1O2。
(4)L的同分异构体Q 是芳香酸, ![]() ,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是________,写出能检验该物质存在的显色反应中所用的试剂及实验现象_______________________。
(6)已知:L→M的原理为:①
②
M的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.v(A) = 0.7mol·L-1·S-1 B.v(B) = 0.3 mol·L-1·S-1
C.v(C) = 0.8mol·L-1·S-1 D.v(D) = 1 mol·L-1·S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式CH3CH2CH=C(C2H5)C≡CH,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
A. 4、3、5B. 4、3、6C. 2、5、4D. 4、6、4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔触的金属锡在300℃左右能直接与氯气作用生成四氯化锡。四氯化锡的熔点-33℃,沸点114℃,遇潮湿空气水解。某学习小组用以下装置制取少量四氯化锡。回答下列问题:
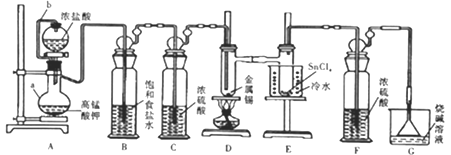
(1)仪器组装完毕,为检查装置的气密性,将装置G中漏斗改为导管且管口浸没于水中,后续操作是__________,说明气密性良好。
(2)仪器a的名称是__________;设计连接管b的目的是_______________。
(3)装置B、F的作用分別是______________、____________。
(4)装置A中反应的离子方程式为______________,排尽装置中的空气后才能点燃D处的酒精灯,判断装置中的空气已排尽的现象是_____________;D中加热的作用之一是加快氯气与金属锡反应,另一作用是__________。
(5)四氯化锡遇潮湿空气时有白色烟雾产生,同时生成白色固体(SnO2·xH2O),该反应的化学方程式为_____________。
(6)实验结束后,若制得SnCl4的质量为2.61g,Cl2的转化率为80%,则消耗KmnO4的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键类型完全相同的是( )
A. CaH2 和 Na2S B. Na2O 和Na2O2
C. CO2 和CaO D. HCl 和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·海南卷)利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准情况)
D.生成H2的量理论上等于0.04 mol Na与水反应产生H2的量(注:2Na+2H2O![]() 2NaOH+H2↑)
2NaOH+H2↑)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com