
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
2SO3(g) △H<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )

A. t2时改变的条件是:只加入一定量的SO2
B. 在t1时平衡常数K1大于t3时平衡常数K2
C. t1时平衡混合气的![]() 大于t3时平衡混合气的
大于t3时平衡混合气的![]()
D. t1时平衡混合气中SO3的体积分数等于t3时平衡混合气中SO3的体积分数
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】有关SiO2或硅酸盐的说法正确的是
A. 水泥、石英玻璃、陶瓷均是硅酸盐产品
B. 硅太阳能电池板所用的是高纯度SiO2
C. 钢化玻璃与普通玻璃成分相同
D. SiO2既能与HF酸反应又能与NaOH反应,故SiO2为两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2、CO)法;③活泼金属置换法;④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石[主要成分是Cu2(OH)2CO3]炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石(主要成分是MgCl2)中炼镁。下列分析不正确的是
A. ①用于(Ⅰ) B. ②用于(Ⅱ) C. ③用于(Ⅲ) D. ④用于(Ⅳ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
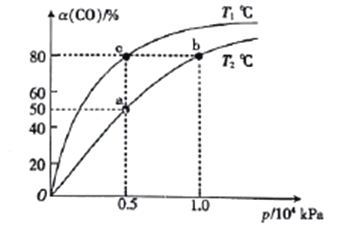
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是 ( )
A. 气体A与气体B的相对分子质量比为m:n
B. 同质量的气体A与B的分子个数比为n:m
C. 同温同压下,A气体与B气体的密度比为n:m
D. 同温同压下,同体积的A气体与B气体的质量比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______

(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上绝大部分卤素都存在于海洋。海水呈微碱性,海水晒盐可以得到粗盐和卤水,对粗盐和卤水进一步加工可以得到氯气、溴以及其他一些重要的化工产品。
完成下列填空:
(1)工业上用电解饱和食盐水的方法获取氯气。写出阴极的电极反应式_______________,该反应为________(选填“氧化”、“还原”)反应。若转移5mol电子,生成氯气______L(标准状况下)。
(2)工业上从卤水获取溴,涉及到“氧化”、“提取”等步骤。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是________________。在“提取”过程中,用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-和BrO3-,同时有CO2生成,写出反应的化学方程式________________________________。
(3)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_____________。
(4)足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com