
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
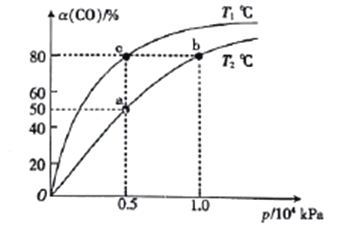
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
【答案】 C2H5OH(g)+3O2(g) 2CO2(g)+3H2O(g) △H=-1253 kJmol-1 > < 温度低于240℃时,反应速率较慢,同时该反应为放热反应,温度高于270℃时,化学平衡逆向移动,转化率降低 K(a)=K(b)<K(c) < 由图可知,随着温度升高,K1减小,则△H1<0,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3
【解析】(1)已知反应 C2H5OH(g)+3O2(g)![]() 2CO2(g)+3H2O(g) 的△H=反应物的键能和-生成物的键能和=(413×5+348×1+351×1+463×1+498×3) kJmol-1 -(799×4+463×6) kJmol-1=-1253 kJmol-1,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为C2H5OH(g)+3O2(g)
2CO2(g)+3H2O(g) 的△H=反应物的键能和-生成物的键能和=(413×5+348×1+351×1+463×1+498×3) kJmol-1 -(799×4+463×6) kJmol-1=-1253 kJmol-1,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为C2H5OH(g)+3O2(g)![]() 2CO2(g)+3H2O(g) △H=-1253 kJmol-1 ;
2CO2(g)+3H2O(g) △H=-1253 kJmol-1 ;
(2)①温度相同时,压强越大反应速率越快,则a、b两点的反位速率:v(b)>v(a);
②压强相同时,温度越高达到平衡所需要的时间越短,则T1<T2;
③温度低于240℃时,反应速率较慢,同时该反应为放热反应,温度高于270℃时,化学平衡逆向移动,转化率降低,再结合催化剂活性,比反应的温度一般控制在240~270℃;
④图中a、b两点温度不变,平衡常数不变,即K(a)=K(b),升高温度平衡逆向移动,平衡常数减小,则K(a)=K(b)<K(c);
(3)由图可知,随着温度升高,K1减小,则△H1<0,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3。


科目:高中化学 来源: 题型:
【题目】利用海洋资源可以获得很多物质。如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等。
(一)从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、 Mg2+、SO42-。
(1)为有效除去Ca2+、 Mg2+、SO42-,加入试剂的合理顺序为___________。
a.先加 NaOH,后加Na2CO3,再加 BaCl2
b.先加NaOH,后加BaCl2,再加Na2CO3
C.先加BaCl2,后加NaOH,再加Na2CO3
(2)加入Na2CO3过程中发生反应的离子方程式为_______________________。
(3)判断试剂BaCl2己经足量的方法是_______________________。
(二)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
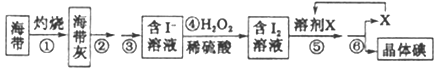
(1)实验时灼烧海带应在___________(填仪器名称)内进行。
(2)步骤④中反应的离子方程式是_______________。
(3)步骤⑤的实验操作为____________,应选用的一种溶剂X可以是____________。
a.苯、酒精 b.四氯化碳、苯 c.汽油、酒精
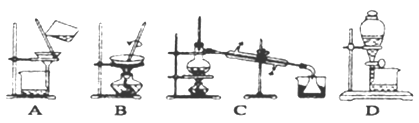
(4)步骤⑥的实验操作应选用下图中的_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为70的烯烃的分子式为_____________;若该烯烃与足量的H2加成后能生
成含3个甲基的烷烃,写出该烯烃一种可能的结构简式_______________;并对其用系统命名法命名________。
(2)有机物A的结构简式为
①若A在光照条件下与氯气发生取代反应,则生成的一氯代物可能有________种结构;
②A是炔烃与氢气加成后的产物,则此炔烃可能有________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A. 单质:生铁、赤铜、青铜
B. 有机物:甲烷、葡萄糖、乙醇
C. 纯净物:冰水混合物、纯碱、98%浓硫酸
D. 氧化物:双氧水、生石灰、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是

A. 该反应的化学方程式为5A+4B![]() 4C
4C
B. 2min前,正反应速率逐渐减小,逆反应速率逐渐增大
C. 用B的浓度变化表示2min内的速率为2mol/(L·min)
D. 2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
2SO3(g) △H<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )

A. t2时改变的条件是:只加入一定量的SO2
B. 在t1时平衡常数K1大于t3时平衡常数K2
C. t1时平衡混合气的![]() 大于t3时平衡混合气的
大于t3时平衡混合气的![]()
D. t1时平衡混合气中SO3的体积分数等于t3时平衡混合气中SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. IA族与VIIA族元素间可形成共价化合物或离子化合物
B. 共价键只存在于共价化合物中
C. 使阴阳离子结合形成化合物的静电作用,叫做离子键
D. 含有离子键的化合物一定是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com