
| m |
| M |
| m |
| n |
| N |
| NA |
| n |
| V |
| 5.6g |
| 28g/mol |
| 0.6mol |
| 2 |
| 40.5g |
| 0.3mol |
| 6.02×1022 |
| 6.02×1023mol-1 |
| 0.3mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、不论放热还是吸热反应主要是由反应物、生成物所具有的总能量相对大小决定 |
| C、镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易腐蚀 |
| D、植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、木炭粉加入蓝墨水中使蓝墨水褪色 |
| B、氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红 |
| C、过氧化钠投入到紫色石蕊溶液中溶液褪色 |
| D、氯化氢通过酸性KMnO4中使酸性KMnO4褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
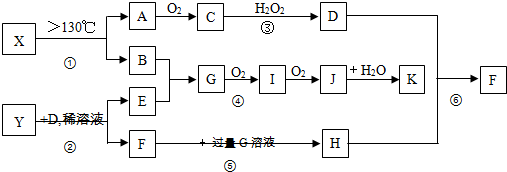
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2molH2的质量是2g |
| B、88g的CO2的物质的量2mol |
| C、1molH2SO4的质量是96g |
| D、2molNaCl的质量是58.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol?L-1 |
| B、0.1mol?L-1 |
| C、0.01mol?L-1 |
| D、10mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(G) |
| c(OH-) |
| c(OH-) |
| c(H+) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com