
| m |
| M |
| n |
| V |
| 6.5g |
| 65g/mol |
| 65g |
| 6.5g |
| 2mol |
| nmol |
| 0.2mol |
| 0.1L |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
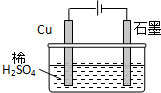
| A、电解过程中,铜电极上有H2产生 | ||||
| B、电解一定时间后,石墨电极上有H2析出 | ||||
| C、整个电解过程中,H+的浓度不断增大 | ||||
D、电解初期,主反应方程式为:Cu+H2SO4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙是地壳中含量最多的元素 |
| B、丙的氢化物比甲的氢化物热稳定性强 |
| C、乙与丙形成的化合物可制作光导纤维 |
| D、甲、乙两种元素形成的化合物中可能既含离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取100mL5mol/LH2SO4,加入400mL水 |
| B、取200mL5mol/LHCl,加水稀释至500mL |
| C、取100 mL5mol/LH2SO4,加水500mL |
| D、取100 mL5mol/LHNO3,加水稀释至500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+ |
| B、Al(OH)3 |
| C、AlO2- |
| D、Al3+和Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿伏加德罗常数是一个纯数,没有单位 |
| B、常用NA表示阿伏加德罗常数 |
| C、阿伏加德罗常数是一个实验值 |
| D、阿伏加德罗常数常用:6.02×1023mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com