
【题目】欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯, 请完成该反应的化学方程式
_____C+____ KMnO4+____H2SO4→____CO2↑+_____MnSO4+ ______K2SO4+_____H2O
(2)焦炭可用于制取水煤气,测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量。
反应的热化学方程式为_________________。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。
CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。

① 判断反应达到平衡状态的依据是___________。(填序号)
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2molCO和一定量的H2充入2L的密闭容器中,充分反应l0min后,达到平衡时测得c(CO)=0.2 mol/L,则以H2表示的反应速率v(H2)=________。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下的燃料电池,其正极反应式:O2+2CO2+4e-=2CO32-,则负极反应式为___________________。
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层淸液,如此处理多次,可使BaSO4 全部转化为BaCO3发生反应:BaSO4(s) + CO32-(aq)=BaCO3(s) +SO42-(aq)。己知某温度下该 反应的平衡常数 K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积 Ksp=______。
【答案】(1)5、4、6、5、4、2、6(2分)
(2)C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ·mol-1(2分)
(3)①BD(2分)②0.16mol/(L·min)(2分)
(4)2CO+2CO32--4e-=4CO2(2分)(5)2.5×10-9(2分)
【解析】
试题分析:(1)反应中C元素的化合价由0升高为+4价,一个碳原子化合价变化4,Mn元素的化合价由+7价降低为+2价,1个高锰酸钾化合价变化5,4和5的最小公倍数为20,由化合价升降总数相等可知,C的化学计量数为4,高锰酸钾的化学计量数为4,最后由质量守恒定律可知得化学反应为5C+4 KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O;
(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.6 kJmol—;
(3)①A.生成CH3OH的速率与消耗CO的速率相等均表示正反应速率,不能说明反应达到平衡状态,A错误;B.混合气体的质量不变,物质的量减小,所以混合气体的平均相对分子质量不变可以说明反应达到平衡状态,B正确;C.混合气体的质量不变,容积不变,则混合气体的密度始终不变,C错误;D.CH3OH、CO、H2的浓度都不再发生变化说明反应达到平衡状态,D正确,答案选BD。
②某温度下,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO浓度变化了1mol/L-0.2mol/L=0.8mol,所以根据方程式可知氢气浓度变化了1.6mol/L,则以H2表示的反应速率v(H2)=1.6mol/L÷10min=0.16 mol /(L·min)。
(4)负极CO失去电子,结合碳酸根生成二氧化碳,则负极电极反应式为2CO + 2CO32- -4e-=4CO2。
(5)根据方程式可知该反应的平衡常数K=![]() =
=![]() =
=![]() =4.0×10-2,所以BaCO3的溶度积Ksp=2.5×10-9。
=4.0×10-2,所以BaCO3的溶度积Ksp=2.5×10-9。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】将一定体积密度为1.84 g/cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol/L的稀硫酸。求:
(1)原浓硫酸的物质的量浓度;
(2)原浓硫酸的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.非金属两原子间不可能形成离子键
B.非金属元素不可能形成离子化合物
C.含有非极性键的分子,不一定是共价化合物
D.离子化合物中一定不含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
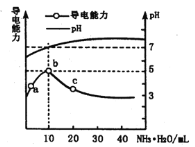
A.ab点导电能力增强,说明HR为弱酸
B.b点溶液pH=7说明NH4R没有发生水解
C.c 点溶液存在 c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有 c(H+)·c(OH-)=KW=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.物质发生化学反应都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在吸热反应中,反应物的总能量高于生成物的总能量
D.需要加热的化学反应一定是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明体检的血液化验单中,葡萄糖为5.9mmol/L。表示该指标的物理量是( )
A.溶解度(s) B.物质的量浓度(c) C.质量分数(w) D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )。
A.蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com