
【题目】常温下向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
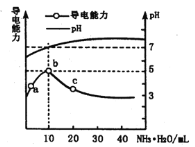
A.ab点导电能力增强,说明HR为弱酸
B.b点溶液pH=7说明NH4R没有发生水解
C.c 点溶液存在 c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有 c(H+)·c(OH-)=KW=1.0×10-14
【答案】B
【解析】
试题分析:常温下,向10 mL0.1 mol/L的HR溶液中逐滴滴人0.l mol/L的NH3·H2O溶液,A、a~b点导电能力增强,发生反应为HR+NH3·H2O=NH4R+ H2O,溶液导电能力增强则说明溶液中电荷浓度增大,故原溶液中电荷浓度少,即单位体积内溶液中自由移动的离子少,则HR为弱电解质,A正确;B、b点导电能力最强,则b点位两者恰好完全反应,溶液溶质为NH4R,NH4+、R—对应的碱、酸均为弱电解质,故两者都会水解,pH=7则说明两者水解程度相同,B错误;C、c点溶液为NH4R、NH3·H2O1:1的混合液,且溶液pH>7,故存在c(OH-)>c(H+),则为NH3·H2O的电离程度大于NH4+的水解程度,故c( NH4+)>c( R-),C正确;D、中整个体系中均为水溶液体系,故常温下,任意点均存在c(H+)×c(OH-)=Kw=l.0×l0-14,D正确;答案选B。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
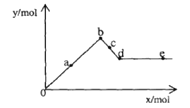
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d—e时溶液中离子的物质的量:Ba2+等于OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:

(1)装置A中发生反应的化学方程式为________________________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在___________(填仪器名称)中反复的灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过_________、___________、过滤、洗法、干燥,即可得到产品CuSO4·5H2O晶体。
(3)将空气或氧气直接通入到钢粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:___________,Fe3++Cu==2Fe2++Cu2+,请写出其第1步反应的离子方程式_________________。
(4)制取的CuSO4溶液和“另一物质”在40~50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 _____________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学反应的实质是旧键断裂和新键形成这一观点,下列不属于化学变化的是
A. 食醋除垢 B. 胆矾晶体受热由蓝色变白色
C. 在稀盐酸中滴入紫色石蕊试液,溶液变红 D. 液氨变成氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应达到平衡的根本原因是
A. 反应混合物中各组分的浓度相等 B. 正逆反应都还在继续进行
C. 正逆反应的速率均为零 D. 正逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯, 请完成该反应的化学方程式
_____C+____ KMnO4+____H2SO4→____CO2↑+_____MnSO4+ ______K2SO4+_____H2O
(2)焦炭可用于制取水煤气,测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量。
反应的热化学方程式为_________________。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。
CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。

① 判断反应达到平衡状态的依据是___________。(填序号)
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2molCO和一定量的H2充入2L的密闭容器中,充分反应l0min后,达到平衡时测得c(CO)=0.2 mol/L,则以H2表示的反应速率v(H2)=________。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下的燃料电池,其正极反应式:O2+2CO2+4e-=2CO32-,则负极反应式为___________________。
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层淸液,如此处理多次,可使BaSO4 全部转化为BaCO3发生反应:BaSO4(s) + CO32-(aq)=BaCO3(s) +SO42-(aq)。己知某温度下该 反应的平衡常数 K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积 Ksp=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 乙醇、乙烯和植物油都能使酸性高锰酸钾溶液褪色
B. 乙醇、乙烷、乙酸都可以与钠反应生成氢气
C. 乙烯能使酸性高锰酸钾溶液褪色
D. 用灼烧闻气味的方法可以区分纯棉织物和纯毛织物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
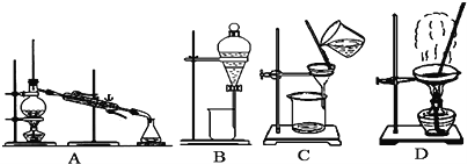
(1)写出图中标序号的对应仪器名称:②_________________,③_______________。仪器②中水流方向为___________(填“上进下出”或 “下进上出”)
(2)选择合适的实验方法分离下列混合物,用代表整套装置的字母填空;
①从氯化钾溶液中得到氯化钾固体,选择装置____________;
②分离饱和食盐水与沙子的混合物,选择装置____________;
③除去自来水中的Cl-等杂质以制取蒸馏水,选择装置____________;
④分离乙醇和水的混合物,选择装置________;
⑤分离汽油和水的混合物,选择装置____________;
(3)分离碘和水的混合物,可选择下列哪种试剂?_______(填序号),所用分离方法为________。
A.四氯化碳 B.乙醇 C.蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com