
【题目】在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:

(1)装置A中发生反应的化学方程式为________________________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在___________(填仪器名称)中反复的灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过_________、___________、过滤、洗法、干燥,即可得到产品CuSO4·5H2O晶体。
(3)将空气或氧气直接通入到钢粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:___________,Fe3++Cu==2Fe2++Cu2+,请写出其第1步反应的离子方程式_________________。
(4)制取的CuSO4溶液和“另一物质”在40~50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 _____________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是___________。
【答案】(1)2H2SO4(浓)+Cu![]() CuSO4+SO2↑+2H2O(2分)
CuSO4+SO2↑+2H2O(2分)
(2)坩埚(2分)蒸发浓缩(1分)冷却结晶(1分)
(3)4Fe2++O2+4H+==4Fe3++2H2O(2分)(4)H2(1分)0.75mol(2分)
【解析】
试题分析:(1)铜与热的浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为2H2SO4(浓)+Cu![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)灼烧物质一般在坩埚中进行,将铜粉全部转化为CuO。再将氧化铜与稀硫酸反应,生成硫酸铜和水,不会产生二氧化硫,再将溶液经过蒸发浓缩,冷却结晶可得到CuSO4·5H2O晶体。
(3)从第二步反应有Fe3+参加反应可知,第一步反应应该是Fe2+被氧化,O2被还原,则反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(4)CuH中的氢为-1价,与盐酸(HCl)中氢为+1价,反应时生成H2,反应方程式为2CuH+2HCl=2CuCl2+2H2+Cu,则2H2~3e-,故收集标况下的H211.2 L,转移的电子数目为0.5mol×3/2=0.75mol。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是
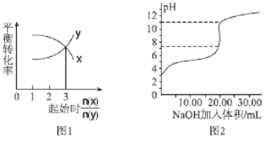
A.—定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y![]() Z
Z
B.图2表示NaOH溶液滴加到0.lmol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
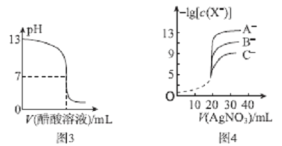
C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)> c(CH3COO- )>c(OH-)>c(H+)
D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与 Ag+反应生成沉淀),由图4可确定首先沉淀的是C-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.某元素原子最外层只有一个电子,则它一定是IA元素
B.任何原子或离子的组成中都含有质子
C.质子数相同的微粒一定属于同一种元素
D.构成原子核的微粒中都含有中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定体积密度为1.84 g/cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol/L的稀硫酸。求:
(1)原浓硫酸的物质的量浓度;
(2)原浓硫酸的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学中常见的4种物质,它们均由短周期元素组成,转化关系如图所示。请针对以下两种情况回答下列问题。
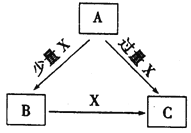
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得白色胶状沉淀B。
① A中含有的金属元素为__________(填元素名称)。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨,此反应的化学方程式为:__________。
(2)若A、B、C的焰色反应均呈黄色,水溶液均呈碱性。
① A中所含有的化学键是________、__________。
②将4.48 L(标准状况下)X通入100 mL3 mol/LA的水溶液后,溶液中离子浓度由大到小的顺序为__________。
③自然界中存在由B或C与H2O按一定比例结晶而成的固体。将一定置的由C与H2O按一定比例形成的晶体溶于水配制成100 mL溶液,测得溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的此晶体加热至恒重,剩余固体的质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
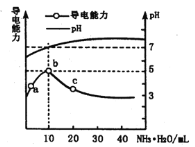
A.ab点导电能力增强,说明HR为弱酸
B.b点溶液pH=7说明NH4R没有发生水解
C.c 点溶液存在 c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有 c(H+)·c(OH-)=KW=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g)△H<0
2SO3(g)△H<0
(1)如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示.根据图示回答下列问题:
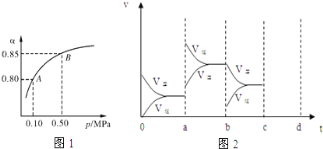
平衡状态由A变到B时平衡常数K(A) K(B)(填“>”、“<”或“=”).
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是 (填字母).
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、SO3的物质的量之比为2:1:2
D.接触室中压强不随时间变化而变化
(4)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~ b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,请把反应速率变化情况画在c~d处.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com