
����Ŀ�����������У�SO2����������SO3��2SO2��g��+O2��g��![]() 2SO3��g����H��0
2SO3��g����H��0
��1�����2min��SO2��Ũ����6mol/L�½�Ϊ2mol/L����ô����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ ��
��2��ij�¶��£�SO2��ƽ��ת��������������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ1��ʾ������ͼʾ�ش��������⣺
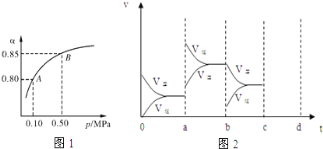
ƽ��״̬��A�䵽Bʱƽ�ⳣ��K��A�� K��B������������������������=������
��3���˷�Ӧ�ں����ܱյ�װ���н��У��ܳ��˵���˷�Ӧ�Ѵﵽƽ��ı�־�� ������ĸ����
A���Ӵ����������ƽ����Է����������ٸı�
B���Ӵ�����SO2��O2��SO3��Ũ����ͬ
C���Ӵ�����SO2��SO3�����ʵ���֮��Ϊ2��1��2
D���Ӵ�����ѹǿ����ʱ��仯���仯
��4��ͼ2��ʾ�÷�Ӧ���ܱ������дﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a�� b�����иı������������ ��b��c�����иı������������ �� ������ѹǿʱ����ѷ�Ӧ���ʱ仯�������c��d����
���𰸡�
��1��1molL��1min��1��2��=����3��AD
��4�����£���СSO3Ũ�ȣ�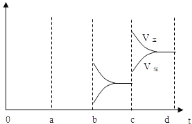 ��
��
��������
�����������1��v��SO2��=![]() =2 molL-1min-1��v��O2����v��SO2��=1��2��v��O2��=
=2 molL-1min-1��v��O2����v��SO2��=1��2��v��O2��=![]() v��SO2��=1molL-1min-1���ʴ�Ϊ��1molL-1min-1��
v��SO2��=1molL-1min-1���ʴ�Ϊ��1molL-1min-1��
��2����ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ���ʣ����淴Ӧ2NO��g��+2CO��g��![]() N2��g��+2CO2��g�� ��ƽ�ⳣ��K=
N2��g��+2CO2��g�� ��ƽ�ⳣ��K=![]() ��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶Ȳ��䣬��ѹǿ���䣬ƽ��״̬��A�䵽Bʱ����k��A��=k��B�����ʴ�Ϊ��=��
��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶Ȳ��䣬��ѹǿ���䣬ƽ��״̬��A�䵽Bʱ����k��A��=k��B�����ʴ�Ϊ��=��
��3��A����������������䣬�淴Ӧ���У���������ʵ�����С��ƽ����Է�����������ƽ����Է����������䣬˵������ƽ��״̬����A��ȷ��B��ƽ��ʱ�Ӵ�����SO2��O2��Ũ��һ������ͬ����ʼ���ʵ���Ϊ2��1����2��1��Ӧ��ƽ��ʱ���ߵ����ʵ���֮��Ϊ2��1��Ũ��֮��Ϊ2��1����B����C��ƽ��ʱ�Ӵ�����SO2��O2��SO3���ʵ���֮�ȿ���Ϊ2��1��2�����ܲ���2��1��2������������ת�����йأ���C����D���淴Ӧ���У���������ʵ�����С���Ӵ�����ѹǿ��С��ѹǿ����ʱ��仯���仯��˵������ƽ��״̬����D��ȷ���ʴ�Ϊ��AD��
��4��aʱ�淴Ӧ���ʴ�������Ӧ���ʣ������淴Ӧ���ʶ�����˵��ƽ��Ӧ���淴Ӧ�����ƶ����÷�Ӧ������Ӧ���ȣ�ӦΪ�����¶ȵĽ����bʱ����Ӧ���ʲ��䣬�淴Ӧ���ʼ�С���ڴ˻�������С��ӦΪ��С�������ԭ��������ѹǿʱ��ƽ��������Ӧ�����ƶ��������淴Ӧ���ʶ�����������Ӧ���ʴ����淴Ӧ���ʣ�ͼ��ӦΪ ���ʴ�Ϊ�����£���СSO3Ũ�ȣ�
���ʴ�Ϊ�����£���СSO3Ũ�ȣ� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ������ijʵ��С��ͬѧ��������ͭ����ȡ��Ӧ�ã����������ʵ�飺

��1��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ________________________��
��2��Ϊ������ɫ��ѧ��Ҫ��ijͬѧ����������ƣ���ͭ����___________(����������)�з��������գ�ʹͭ�������ַ�Ӧ��������ͭ���ٽ�����ͭ��ϡ���ᷴӦ����Ӧ����Һ����_________��___________�����ˡ�ϴ����������ɵõ���ƷCuSO4��5H2O���塣
��3��������������ֱ��ͨ�뵽�ַ���ϡ����Ļ�����У������ڳ����¼�������Ӧ����ӦҺ�м�����FeSO4����������������Ӧ����������ͭ���䷴Ӧ���̵ĵ�2���ǣ�___________��Fe3++Cu==2Fe2++Cu2+����д�����1����Ӧ�����ӷ���ʽ_________________��
��4����ȡ��CuSO4��Һ�͡���һ���ʡ���40~50����ʱ������һ�����������⻯��ͭ��CuH������CuH�ܽ���ϡ������ʱ������һ�����壬���������� _____________,���ռ��ⶨ���ɵĸ�����Ϊ�����11.2 L����ԭ�����ӵõ��ӵ����ʵ�����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. �Ҵ�����ϩ��ֲ���Ͷ���ʹ���Ը��������Һ��ɫ
B. �Ҵ������顢���ᶼ�������Ʒ�Ӧ��������
C. ��ϩ��ʹ���Ը��������Һ��ɫ
D. ����������ζ�ķ����������ִ���֯��ʹ�ë֯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���������ݻ���ȵ�����ƿ��һ��װO2��һ��װCH4����ƿ���������ͬ�� ��
A��ԭ������ B������ C�������� D���ܶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��Ⱥ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ����ǣ� ��
A. CCl4 B. CO2 C. NH4Cl D. C2H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����б�ʾ������װ����ϵ������ǣ� ��
A.ֲ�������ã����ܡ���������
B.ԭ��أ����ܡ���ѧ��
C.ľ���շ����������ܡ�����
D.̫������ˮ�������ܡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǣ� ��
A. ����Ũ���ᡢŨ���Ṳ�Ȳ�����55��60����Ӧ����������
B. ����ϩ�ں��������´�����������һ�������
C. ��ϩ��������Ȼ�̼��Һ��Ӧ����1,2-��������
D. �ױ��������ڹ����·�Ӧ��Ҫ����2,4-���ȼױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
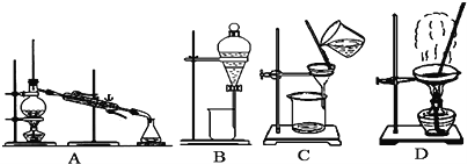
��1��д��ͼ�б���ŵĶ�Ӧ�������ƣ���_________________����_______________����������ˮ������Ϊ___________(��Ͻ��³����� ���½��ϳ���)
��2��ѡ����ʵ�ʵ�鷽���������л����ô�������װ�õ���ĸ��գ�
�ٴ��Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��____________��
�ڷ��뱥��ʳ��ˮ��ɳ�ӵĻ���ѡ��װ��____________��
�۳�ȥ����ˮ�е�Cl-����������ȡ����ˮ��ѡ��װ��____________��
�ܷ����Ҵ���ˮ�Ļ���ѡ��װ��________��
�ݷ������ͺ�ˮ�Ļ���ѡ��װ��____________��
��3��������ˮ�Ļ�����ѡ�����������Լ���_______(�����)�����÷��뷽��Ϊ________��
A�����Ȼ�̼ B���Ҵ� C������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�����Ϊԭ��������������������к�Fe2O3��SiO2��Al2O3��MgO�������������Ʊ�����(Fe2O3)�Ĺ���������

��1�����ܹ�����Fe2O3��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ ��������A����Ҫ�ɷݵĻ�ѧʽΪ ��
��2����ԭ�����м���FeS2��Ŀ���ǽ���Һ�е�Fe3 +��ԭΪFe2 +��������������ΪH2SO4������ɸ÷�Ӧ�����ӷ���ʽ��FeS2 + 14Fe3 + + H2O=15Fe2 + + SO42- + ��
��3�����������У�O2��NaOH��Fe2+��Ӧ�����ӷ���ʽΪ ��
��4��Ϊ��ȷ�����������������������Ҫ������Һ��pH�ķ�Χ�� (�������ӳ�����pH���±�)����ҺB���Ի��յ�������(д��ѧʽ)________________��
������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
��ʼ����pH | 2.7 | 3.8 | 7.6 | 9.4 |
��ȫ����pH | 3.2 | 5.2 | 9.7 | 12.4 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com