
【题目】铜在一定条件下也会生锈,其主要成分是铜绿,化学式为Cu2(OH)nCO3,式中n等于
A. 1 B. 2 C. 3 D. 4
科目:高中化学 来源: 题型:
【题目】I.合成氨的原料气H2可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述
能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
II.液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
III.(1)右图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
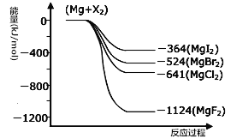
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体(CH4)和沉淀生成。写出CH3MgCl水解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热NaHCO3饱和溶液,测得该溶液的pH随温度发生如下变化
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为该溶液的pH升高的原因是HCO3-的水解程度增大,碱性增强。
乙同学认为,该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。
(1)查阅资料,发现NaHCO3的分解温度为150℃,丙断言_________(填“甲”或“乙”)判断是错误的。
(2)关于NaHCO3饱和水溶液的表述正确的是_________
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
(3)某同学用标准盐酸,测定某天然苏打水的NaHCO3的浓度,则测定中应选择的指示剂为 ,若量取20.00mL天然苏打水,则应在 (填仪器名称)中量取
(4)已知0.05mol/LBa(OH)2溶液的pH为11,且该温度下,H2CO3的Ka1=4×10-7,Ka2=4×10-11,则0.1mol/LNa2CO3溶液的pH近似为 (用对数表示)
(5)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(OH)3沉淀,从而除去Fe3+,该反应的离子方程式可表示为 ,该反应的平衡常数为 。(已知常温下的溶度积常数:Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na是一种非常重要的金属单质。
(1)下列关于金属钠的叙述错误的是( )
A.钠的还原性很强,只能以化合态存在于自然界
B.钠质地柔软,可用小刀切割,保存在煤油中
C.从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中
D.钠失火后可用大量水或泡沫灭火器扑灭

(2)在试管内注入煤油和FeSO4溶液,静置后将一块钠投入试管中,则钠落在 (a、b、c)处,请一步写出发生的相应总离子反应方程式为 。
(3)将少量的Na投入到饱和NH4Cl溶液中,反应产生的两种气体为 和 (填化学式)。请一步写出相应的化学反应方程式 。
(4)将少量的Na投入到足量的Ca(HCO3)2溶液中,请一步写出相应的总离子反应方程式 。
(5)已知有150mL 1mol/L NaOH 溶液,向该溶液通入标况下2.24LCO2请一步写出相应的总离子反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:

实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=_______________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的______________、_____________(填字母编号)。
A增大压强 B减小压强 C升高温度 D降低温度 E使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g)![]() N2O4(g)。
N2O4(g)。
T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
现有CO、H2和CO2组成的混合气体112.0 L(标准状况)完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为
A.80% B.40% C.60% D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
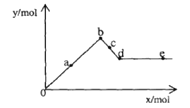
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d—e时溶液中离子的物质的量:Ba2+等于OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:

(1)装置A中发生反应的化学方程式为________________________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在___________(填仪器名称)中反复的灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过_________、___________、过滤、洗法、干燥,即可得到产品CuSO4·5H2O晶体。
(3)将空气或氧气直接通入到钢粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:___________,Fe3++Cu==2Fe2++Cu2+,请写出其第1步反应的离子方程式_________________。
(4)制取的CuSO4溶液和“另一物质”在40~50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 _____________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com