
【题目】I.合成氨的原料气H2可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述
能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
II.液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
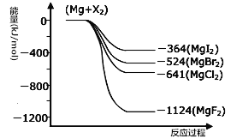
III.(1)右图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体(CH4)和沉淀生成。写出CH3MgCl水解的化学方程式 。
【答案】I.(1)60%(2)cdII.![]()
III.(1)放热(2)CH3MgCl+H2O═CH4↑+Mg(OH)Cl
【解析】
试题分析:I.(1)依据化学平衡三段式列式计算平衡浓度,℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL-1,
CO(g)+H2O(g)═CO2 (g)+H2(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L) 0.12 0.12 0.12 0.12
平衡量(mol/L) 0.08 0.08 0.12 0.12
平衡时CO的转化率=0.12mol/L÷0.2mol/L×100%=60%;
(2)化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,CO(g)+H2O(g)═CO2 (g)+H2(g),反应是气体体积不变反应;a.反应过程中和平衡状态下压强相同,容器内压强不随时间改变,不能说明反应达到平衡状态,故a不符合;b.混合气体质量守恒,反应前后气体体积不变,反应过程中和平衡状态下,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故b不符合;c.单位时间内生成amolCO2的同时消耗amolH2,说明二氧化碳或氢气的正逆反应速率相同,说明反应达到平衡状态,故c符合;d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6,依据反应前后气体物质的量相同,可以利用物质的量代替浓度计算浓度商和平衡常数比较,Q=(6×6)/(1×16)=2.25=K,说明反应达到平衡状态,故d符合;故答案为cd;
II.:(1)由反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3③
则反应![]() 可得到反应①,则△H1=
可得到反应①,则△H1=![]() ;
;
III.(1)由图象可知,Mg与卤素单质的能量高于卤化物,依据能量守恒判断,反应是放热反应;
(2)CH3MgCl水解化合价不变,CH3MgCl中,Cl元素的化合价是-1价,H元素的化合价是+1价,C元素的化合价是-4价,镁元素的化合价是+2价,所以CH3MgCl水解生成氢氧化镁、氯化氢和甲烷或Mg(OH)Cl,水解方程式为:CH3MgCl+H2O═CH4↑+Mg(OH)Cl↓。


科目:高中化学 来源: 题型:
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,把溴置换出来,再用空气将嗅吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有①_________________(写出化学方程式);②3Br2+3CO![]() ===BrO
===BrO![]() +5Br-+3CO2↑;③BrO
+5Br-+3CO2↑;③BrO![]() +5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
+5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:______________________。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是________(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨形成的原理之一可简示如下:
![]()
请回答下列问题:
(1)A物质的化学式为________,B物质的化学式为__________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)雨水的pH<5.6时,就判断为酸雨。已知pH=-lgc(H+),经测定某雨水中只含硫酸,且其浓度为5×10-5 mol·L-1,则这次降雨__________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度,在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生的途径可采取的措施是______________________。
A.少用煤作燃料
B.把工厂的烟囱造高
C.燃料脱硫
D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________,理由是
_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验室将药品分类后放在不同的药品柜里,已存放的部分药品如下:
药品柜 | 甲 | 乙 | 丙 | 丁 |
药品 | 硫黄、红磷 | 镁、锌 | 硫酸、硝酸 | 氢氧化钠、氢氧化钙 |
该实验室新购进一些铜片,应将它放在 ( )
A.甲柜 B.乙柜 C.丙柜 D.丁柜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应处于平衡状态时,下列说法正确的是( )
A.反应不再进行
B.反应物浓度等于生成物浓度
C.正反应速率不等于逆反应速率
D.各组分浓度不再随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
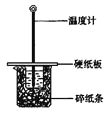
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会 __ __
(5)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过初中和高中有机化合物的学习,你认为下列有关有机化合物的说法中正确的是( )
A.凡是含有碳元素的化合物都是有机化合物
B.所有的有机化合物均难溶解于水
C. 有机物组成元素较少,而有机物的种类繁多
D. 完全燃烧只生成CO2和H2O的有机物是烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①丁烷 ②2-甲基丙烷 ③正戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷等物质的沸点的排列顺序正确的是( )
A.③>④>⑤>①>② B.⑤>④>③>②>①
C.①>②>③>④>⑤ D.②>①>⑤>④>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com