
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,把溴置换出来,再用空气将嗅吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有①_________________(写出化学方程式);②3Br2+3CO![]() ===BrO
===BrO![]() +5Br-+3CO2↑;③BrO
+5Br-+3CO2↑;③BrO![]() +5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
+5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:______________________。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是________(填序号)。
①乙醇 ②四氯化碳 ③硝酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】量取100 mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4 mL四氯化碳,用力振荡后静置,实验现象为
A. 液体分层,上层为四氯化碳层,黄色 B. 液体分层,上层为水层,紫色
C. 液体分层,下层为四氯化碳层,紫色 D. 液体分层,下层为水层,黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

①由图1可知SCR技术中的氧化剂为: 。
②图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为: 。
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图3所示,脱氮效果最佳的c(NO2)/c(NO)= 。已知生成1 mol N2反应放出的热量为Q kJ,此时对应的脱氮反应的热化学方程式为 。

(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l)H2SO3(l)H+(aq)+HSO![]() (aq) Ⅰ
(aq) Ⅰ
HSO![]() (aq) H+(aq)+SO
(aq) H+(aq)+SO![]() (aq) Ⅱ
(aq) Ⅱ
Ca(OH)2(s) Ca2+(aq)+2OH-(aq) Ⅲ
Ca2+(aq)+SO![]() (aq) CaSO3(s) Ⅳ
(aq) CaSO3(s) Ⅳ
④步骤Ⅱ的平衡常数K的表达式为 。
⑤该温度下,测定吸收后液体中c(Ca2+)一直保持为0.70 mol/L,已知Ksp(CaSO3)=1.4×10-7,试计算吸收后溶液中的SO![]() 的浓度。(写出计算过程)
的浓度。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各粒子的物质的量浓度关系正确的是
A.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③
C.0.2 mol/L的NaHCO3溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
D.等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO![]() )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
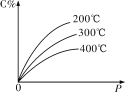
A.达到平衡后,若升高温度,平衡右移
B.达到平衡后,加入催化剂C%增大
C.化学方程式中“n>e+f”
D.达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.合成氨的原料气H2可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述
能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
II.液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
III.(1)右图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
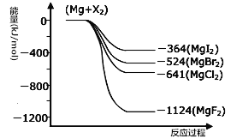
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体(CH4)和沉淀生成。写出CH3MgCl水解的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com