

| mg |
| 233g/mol |
| m |
| 233 |
| m |
| 233 |
| 22.4m |
| 233 |
| ||
| VL |
| m×22.4 |
| 233V |
| m×22.4 |
| 233V |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
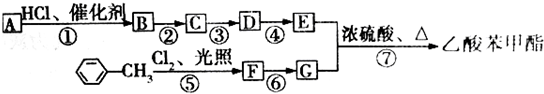
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH |
| B、(CH3)3COH |
| C、CH3CHOHCH3 |
| D、CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、SO42-、Na+、Cl- |
| B、Na+、CO32-、H+、K+ Ba2+ |
| C、Ag+、NO3-、K+、Cl- |
| D、Mg2+、H+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
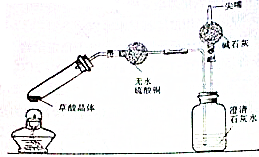 有资料表明:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,是一种白色固体,易溶于水,其熔点为101.5℃,在157℃升华,其钙盐不溶于水.某校化学研究性学习小组为探究草酸受热分解的产物,甲同学设计如图所示的装置.装置中试管口向上倾斜,其原因是
有资料表明:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,是一种白色固体,易溶于水,其熔点为101.5℃,在157℃升华,其钙盐不溶于水.某校化学研究性学习小组为探究草酸受热分解的产物,甲同学设计如图所示的装置.装置中试管口向上倾斜,其原因是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(2)(3) |
| B、(4)(5)(6) |
| C、(3)(4)(5) |
| D、(1)(2)(6) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com