
| 实验过程 | 实验现象 | 结论 |
| 向盛有5 mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管. | 无明显现象 | |
| 向盛有5 mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管. | 试管中有大量气泡产生,带火星的木条复燃 | |
| 实验过程 | 实验现象 | 结论 |
| | | 起催化作用的不是Cl- |
| | | 起催化作用的是Fe3+ |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源:不详 题型:单选题
 pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
| A.①②⑤ | B.只有②④ | C.只有②③ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4+ +OH-的平衡,如果使平衡向逆反应方向移动,同时使c(OH-)增大,应加入
NH4+ +OH-的平衡,如果使平衡向逆反应方向移动,同时使c(OH-)增大,应加入| A.氯化铵固体 | B.硫酸 | C.NaOH固体 | D.大量水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

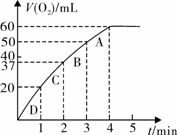
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3 | B.CH3COONa | C.NaOH | D.NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将H2SO4溶液改为浓硫酸 | B.用1mol/LH2SO4溶液代替原H2SO4溶液 |
| C.用锌粉代替块状锌 | D.用同浓度热的H2SO4溶液代替原H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率通常只能用反应物浓度的减少量表示 |
| B.决定反应速率的主要因素是反应物的性质 |
| C.化学平衡状态指的是指化学反应不再进行的状态 |
| D.加入催化剂可加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间 |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com