
【题目】化合物a、b、c的键线式如下图。下列说法正确的是

A. b和c 互为同分异构体 B. b的一氯代物(不含立体异构)有7种
C. a和b分子中所有碳原子均处于同一平面上 D. a、b和c在一定条件下均能与H2发生加成反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用生产甲醇的废催化剂(主要成分为ZnO和CuO,还含有少量有机杂质等)制散CuCl和ZnO的工艺流程如下:
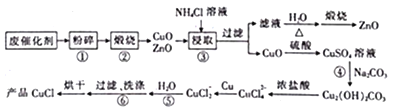
已知用NH4Cl溶液设取时.发生的主要反应如下,
ZnO(s)+2NH4Cl(aq)![]() Zn(NH3)2Cl2(aq)+H2O(l)K1=0.042
Zn(NH3)2Cl2(aq)+H2O(l)K1=0.042
CuO(s)+2NH4Cl(aq)![]() Cu(NH3)2Cl2(aq)+H2O(l)K2=0.0065
Cu(NH3)2Cl2(aq)+H2O(l)K2=0.0065
回答下列同题:
(1)预处理时,废催化剂需进行“粉碎”的主要目的是________;步骤②中“煅烧”的目的是______________。
(2)步骤④发生反应的离子方程式为______________________________。
(3)步骤⑤加H2O稀释的目的是____________________________________________。
(4)步骤⑥过滤、洗涤时,若要检验是否洗涤干净,其实验操作是_____________________。
(5)准确称取mg产品CuCl,将其溶于稍过量的FeCl3溶液中,充分溶解后、加入适量的稀硫酸,用cmol·L-1的K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液的体积为VmL。已知滴定时Cr2O72-被还原为Cr3+,则滴定过程中发生反应的离子方程式为______________________;该反应中氧化剂与还原剂的物质的量之比为________;该产品中CuCl的质量分数为________(用含c、m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数为1~18的元素中,下列叙述正确的是
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.原子最外层电子数不能超过8个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生下列反应,其中属于盐类水解反应的是( )
A. Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. HCO3-+ H2O![]() H3O++ CO32-
H3O++ CO32-
C. H2S![]() H++HS-
H++HS-
D. NH4++2H2O![]() NH3·H2O + H3O+
NH3·H2O + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的重要原料,而含氮化合物的用途广泛。回答下列问题:
(1)两个常见的固氮反应为:
N2(g)+O2(g)![]() 2NO(g)…………(Ⅰ)
2NO(g)…………(Ⅰ)
N2(g)+3H2(g)![]() 2NH3(g)…………(Ⅱ)
2NH3(g)…………(Ⅱ)
①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=_________________。
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
温度/K | 298 | 473 | 673 |
Kp | 62(KPa)-2 | 6.2×10-5(KPa)-2 | 6.0×10-8(KPa)-2 |
则反应(Ⅱ) 的ΔH________0(填“>”、“<”或“=”)
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:
[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g)![]() [Cu(NH3)3] ]Ac·CO(aq)
[Cu(NH3)3] ]Ac·CO(aq)
ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为________________________。
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H= -907kJmol-1
4NO(g)+6H2O(g) △H= -907kJmol-1
②4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H= -1269kJmol-1
2N2(g)+6H2O(g) △H= -1269kJmol-1
其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是___________________;
T℃时N2和O2反应生成NO的热化学方程式为________________________________。
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:
4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O
实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为____mg·L-1;下列铵盐不适合用甲醛法测定含氮量的是____________(填标号)。
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(NH2)2(尿素)在制备氢气,碳酸二甲酯及烟气脱硫、脱硝等方面有着广泛的应用。回答下列问题:

(1)电解尿素的碱性溶液制备氢气的装置如右图所示,a极是________;通电时,阴极周围溶液的pH________(填“增大”或“减小”);阳极的电极反应式为________。
(2)尿素合成碳酸二甲酯的相关反应及平衡常数的对数值与温度的关系如下:
(Ⅰ)2CH3OH(l)+CO(NH2)2(1)![]() CH3OCOOCH3(l)+2NH3(g)△H1
CH3OCOOCH3(l)+2NH3(g)△H1
(Ⅱ)CH3OH(l)+CO(NH2)2(l)![]() CH3OCONH2(l)+NH3(g)△H2
CH3OCONH2(l)+NH3(g)△H2
(Ⅲ)CH3OCONH2(l)+CH3OH(l)![]() CH3OCOOCH3(l)+NH3(g)△H3
CH3OCOOCH3(l)+NH3(g)△H3

①△H1=_______(用△H2和△H3表示);平衡常数的对数lnK(Ⅰ)=________[用lnK(Ⅱ)和lnK(Ⅲ)表示]。
②对于反应(Ⅱ),升高温度,化学平衡向________(“正”或“逆”)反应方向移动。
③为提高CH3OCOOCH3的产率,可采取的措施有________________________________(列举2点)。
(3)尿素中添加NaClO2所得混合溶液可用于烟气脱硫、脱硝。用含NO和SO2的混合烟气进行实验。混合液中NaClO2的质量分数与NO和SO2的脱除率关系如图所示。

①含SO2的烟气(含O2)通过尿素溶液得到的盐为_________;NO2与尿素溶液反应。生成N2和另外两种氧化物,写出该反应的化学方程式:_______________________________。
②若用纯尿素溶液,则NO的脱除率仅约为15%,说明NaClO2的作用是_____________。
③SO2的脱除率总是比NO的大,其原因是____________________________(列举2点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com