
����Ŀ��CO(NH2)2(����)���Ʊ�������̼����������������������ȷ������Ź㷺��Ӧ�á��ش��������⣺

(1)������صļ�����Һ�Ʊ�������װ������ͼ��ʾ��a����________��ͨ��ʱ,������Χ��Һ��pH________(�����С��)�������ĵ缫��ӦʽΪ________��
(2)���غϳ�̼�����������ط�Ӧ��ƽ�ⳣ���Ķ���ֵ���¶ȵĹ�ϵ���£�
(��)2CH3OH(l)+CO(NH2)2(1)![]() CH3OCOOCH3(l)+2NH3(g)��H1
CH3OCOOCH3(l)+2NH3(g)��H1
(��)CH3OH(l)+CO(NH2)2(l)![]() CH3OCONH2(l)+NH3(g)��H2
CH3OCONH2(l)+NH3(g)��H2
(��)CH3OCONH2(l)+CH3OH(l)![]() CH3OCOOCH3(l)+NH3(g)��H3
CH3OCOOCH3(l)+NH3(g)��H3

�١�H1=_______(�á�H2�͡�H3��ʾ);ƽ�ⳣ���Ķ���lnK(��)=________[��lnK(��)��lnK(��)��ʾ]��
�ڶ��ڷ�Ӧ(��),�����¶ȣ���ѧƽ����________(���������桱)��Ӧ�����ƶ���
��Ϊ���CH3OCOOCH3�IJ���,�ɲ�ȡ�Ĵ�ʩ��________________________________(�о�2��)��
(3)����������NaClO2���û����Һ���������������������ú�NO��SO2�Ļ����������ʵ�顣���Һ��NaClO2������������NO��SO2���ѳ��ʹ�ϵ��ͼ��ʾ��

�ٺ�SO2������(��O2)ͨ��������Һ�õ�����Ϊ_________;NO2��������Һ��Ӧ������N2���������������д���÷�Ӧ�Ļ�ѧ����ʽ��_______________________________��
�����ô�������Һ����NO���ѳ��ʽ�ԼΪ15%,˵��NaClO2��������_____________��
��SO2���ѳ������DZ�NO�Ĵ�,��ԭ����____________________________(�о�2��)��
���𰸡� ���� ���� CO(NH2)2+8OH--6e-=CO32-+N2��+6H2O ��H2+��H3 lnK(��)+lnK(��) �� �����¶�,��Сѹǿ (NH4)2SO4 6NO2+4CO(NH2)2=7N2+4CO2+8H2O ��NO����Ϊ������ˮ��NO2�ȸ������� SO2���ܽ�ȱ�NO�Ĵ�,NO��CO(NH2)2��Ӧ�Ļ�ܱ�SO2�Ĵ�
��������(1)��������������������������a����������ͨ��ʱ,����ˮ��������������ӵõ��Ӳ�������������������Ũ��������Χ��Һ��pH��������). CO(NH2)2�ڼ��������µõ��Ӳ���CO32-��N2���缫��ӦʽΪCO(NH2)2+8OH--6e-=CO32-+N2��+6H2O��(2) ����֪��(��)CH3OH(l)+CO(NH2)2(l)![]() CH3OCONH2(l)+NH3(g)��H2
CH3OCONH2(l)+NH3(g)��H2
(��)CH3OCONH2(l)+CH3OH(l)![]() CH3OCOOCH3(l)+NH3(g)��H3
CH3OCOOCH3(l)+NH3(g)��H3
���ݸ�˹���ɣ���(��)+ (��)�÷�Ӧ(��)2CH3OH(l)+CO(NH2)2(1)![]() CH3OCOOCH3(l)+2NH3(g)��H1=��H2+��H3����K=(��)= K(��) K(��)����lnK(��)= lnK(��)+lnK(��)���ڸ���ͼ�����߱仯��֪�������¶�lnK(��)������K(��)����ѧƽ��������Ӧ�����ƶ�����Ϊ���CH3OCOOCH3�IJ���,��ʹ��Ӧ(��)CH3OCONH2(l)+CH3OH(l)
CH3OCOOCH3(l)+2NH3(g)��H1=��H2+��H3����K=(��)= K(��) K(��)����lnK(��)= lnK(��)+lnK(��)���ڸ���ͼ�����߱仯��֪�������¶�lnK(��)������K(��)����ѧƽ��������Ӧ�����ƶ�����Ϊ���CH3OCOOCH3�IJ���,��ʹ��Ӧ(��)CH3OCONH2(l)+CH3OH(l)![]() CH3OCOOCH3(l)+NH3(g)������Ӧ�����ƶ����÷�ӦΪ���������������ȷ�Ӧ���ɲ�ȡ�Ĵ�ʩ�������¶�,��Сѹǿ���ٺ�SO2������(��O2)ͨ��������Һ�õ�����Ϊ������(NH4)2SO4;NO2��������Һ��Ӧ������N2���������������������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��6NO2+4CO(NH2)2=7N2+4CO2+8H2O�������ô�������Һ����NO���ѳ��ʽ�ԼΪ15%,˵��NaClO2�������ǽ�NO����Ϊ������ˮ��NO2�ȸ��������SO2���ѳ������DZ�NO�Ĵ�,��ԭ����SO2���ܽ�ȱ�NO�Ĵ�,NO��CO(NH2)2��Ӧ�Ļ�ܱ�SO2�Ĵ�
CH3OCOOCH3(l)+NH3(g)������Ӧ�����ƶ����÷�ӦΪ���������������ȷ�Ӧ���ɲ�ȡ�Ĵ�ʩ�������¶�,��Сѹǿ���ٺ�SO2������(��O2)ͨ��������Һ�õ�����Ϊ������(NH4)2SO4;NO2��������Һ��Ӧ������N2���������������������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��6NO2+4CO(NH2)2=7N2+4CO2+8H2O�������ô�������Һ����NO���ѳ��ʽ�ԼΪ15%,˵��NaClO2�������ǽ�NO����Ϊ������ˮ��NO2�ȸ��������SO2���ѳ������DZ�NO�Ĵ�,��ԭ����SO2���ܽ�ȱ�NO�Ĵ�,NO��CO(NH2)2��Ӧ�Ļ�ܱ�SO2�Ĵ�


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������a��b��c�ļ���ʽ����ͼ������˵����ȷ����

A. b��c ��Ϊͬ���칹�� B. b��һ�ȴ�����������칹����7��
C. a��b����������̼ԭ�Ӿ�����ͬһƽ���� D. a��b��c��һ�������¾�����H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol/L�������ͬ��HA��Һ��BOH ��Һ��ϣ�������Һ�������Ϊ100 mL,��Һ���������ҺpH �Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. V1��ʾHA ��Һ�������V2��ʾBOH ��Һ�����
B. Ka( HA) ��Kb( BOH) ����������ȣ���Ϊ10-6
C. y��ʱ��c(B+)=c(A-)=c(OH-)=c(H+)
D. x��y��z ��ʾ����ʱˮ�ĵ���̶�:y>x=z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�û������˵����ȷ���ǣ� ��
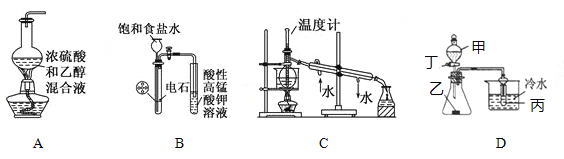
A. ʵ��������ϩ
B. ʵ��������Ȳ����֤��Ȳ�ܷ���������Ӧ
C. ʵ�����з���ʯ��
D. ����Ϊ���ᣬ��Ϊ����(��״),��Ϊ��������Һ�����װ�ò�������֤���ᡢ̼�ᡢ�������Ե�ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��31Ga��̬ԭ�ӵĺ�������Ų�ʽ��___________��C��N��O����Ԫ�ص�һ�����ܴӴ�С��˳����____________��д��һ���� OH- ��Ϊ�ȵ�����ķ���Ϊ_________________(�ѧʽ)��
��2����(N2H4)���ӿ���ΪNH3�����е�һ����ԭ�ӱ���NH2��������ȡ���γɵ���һ�ֵ����⻯�
��NH3���ӵĿռ乹����_________��N2H4�����е�ԭ�ӹ�����ӻ�������_______��
�����������ᷴӦ����N2H6SO4��N2H6SO4�����������������ͬ����N2H6SO4�ľ����ڲ�����__________(����)
a. ���Ӽ� b. ���ۼ� c. ��λ�� d. ���»���
��ͼ1��ʾij�ֺ����л�������Ľṹ���������4����ԭ�ӷֱ�λ�����������4�����㣨��ͼ2���������ڴ��ڿ�ǻ����Ƕ��ij���ӻ���Ӳ��γ�4���������ʶ�����з��ӻ������У��ܱ����л�������ʶ�����________�����ţ���
a. CF4 b. NH4+ c.CH4 d. H2O

��3��������֣�ֻ��C��Mg��Ni����Ԫ�ص�ij�־�����г����ԡ��þ����һ��������ͼ3��ʾ����þ���Ļ�ѧʽΪ ___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��״���£���ϩ(C2H4)��һ����ɫ���壬���п�ȼ�ԣ���ȼ�շ�Ӧ�Ļ�ѧ����ʽΪ:C2H4+3O2![]() 2X+2H2O���������й�˵����ȷ����( )
2X+2H2O���������й�˵����ȷ����( )
A. ��������Ԫ�صĻ��ϼ�Ϊ-2��
B. ˮ�����л�������
C. X��̼����Ԫ�ص�ԭ�Ӹ�����Ϊ1:2
D. �÷�Ӧ���ڻ��Ϸ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ȵ������ҵ��µĴ�л�����ۺ�֢���Ը�Ѫ��Ϊ��Ҫ��־���������������ʳƷ��ȱ���˶�����������
��1��Ѫ����ָѪҺ�е�������(C6H12O6)������˵����ȷ����________��
A������������̼ˮ����������ʽ�ɱ�ʾΪC6(H2O)6����ÿ�������Ƿ����к�6��H2O
B�����������Ǹߣ��������Ƶ�������ͭ����Һ����ⲡ����Һ�е�������
C��������Ϊ�����ṩ����
D������ˮ������ղ�����������
��2��ľ�Ǵ�[CH2OH(CHOH)3CH2OH]��һ����ζ����������ʳ�ú�Ѫ�Dz������ߡ���Ԥ��ľ�Ǵ���һ�ֻ�ѧ���ʣ�___________________________________________________��
��3�������˲������ƣ��ƾ��ڸ����ڿɱ�ת�����л���A��A���й�����ʵ�������£�
��.ͨ����Ʒ�����ײ��A����Է�������Ϊ60��
��.�˴Ź�����ԭ�ӹ����ܶ��л��������ͬЧ��ԭ�Ӹ�����ͬ�ķ�ֵ(�ź�)�����ݷ�ֵ(�ź�)����ȷ����������ԭ�ӵ��������Ŀ�����磺�Ҵ�(CH3CH2OH)��������ԭ��(ͼ��)�����ⶨ���л���A�ĺ˴Ź�������ʾ��ͼ��ͼ����ʾ��

��.��A����ˮ������ʯ����Һ��������Һ��졣��д��A�Ľṹ��ʽ��_________________________________________________��
��4���������˶���߲˺Ͷ���ʳƷ���߲��и�����ά�أ�����ʳƷ�и��������ʡ�����˵���������________(�����)��
A�������ʶ�������Ȼ�л��߷��ӻ�����Ҷ�������ˮ
B������������ζ�ķ�����������ϳ���ά����ë
C�������ڲ�����ά��ˮ��ø���˲���������ά�أ�����߲��е���ά�ض���û���ô�
D�������ߡ�ҽ�þƾ���ɱ������������Ϊ������ʹϸ���ĵ����ʱ���
E������Ȼ�����Ƴ���������ɼ���Ⱦ�϶�����ĸ�����
��5���㽶���ڸ���ˮ���������˲���ʳ�á���ϩ���㽶�Ĵ����������ʹ������Ȼ�̼��Һ��ɫ����д���÷�Ӧ�Ļ�ѧ����ʽ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̽��սʿ�����������´���ѧ�Թ����Թ��������������˵�Ұ���������������ᷴӦ�����ʣ����������ܿ����ǣ��������ͨ����
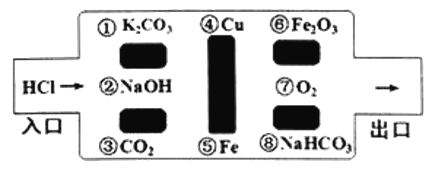
��1������������߳��Թ�������� �� �� �����ڣ����������д����______________
��2���������Ե�������Ļ�ѧ��Ӧ�У������û���Ӧ����________________________���û�ѧ����ʽ��ʾ�������ڸ��ֽⷴӦ����_____����
��3�����������У����������߳���·����������������Թ�����______������ĸ��
A��Ca(OH)2 B��H2SO4 C��CuSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10 mol��L-1NaOH��Һ�ֱ�ζ�20.00 mLŨ�Ⱦ�Ϊ 0.10mol L-1��CH3COOH(Ka=1.75��10-5)��Һ��HCN (Ka=4.9��10-10)��Һ���õζ�������ͼ������˵����ȷ����

A. ����I�����ߢ�ֱ��������CH3COOH��HCN
B. ��ۺ͵����ʾ��Һ�У�c(CN-)=c(CH3COO-)
C. ��ٺ͵����ʾ��Һ�У�c��CH3COO-��-c��CN-��=c��HCN��-c��CH3COOH��
D. �ڵ�ں͢�֮�䣨�������˵������ڹ�ϵ�� c(Na+)>c(A-)>c(H+)>c(OH-) (A-������Һ�е�������ӣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com