
����Ŀ����̽��սʿ�����������´���ѧ�Թ����Թ��������������˵�Ұ���������������ᷴӦ�����ʣ����������ܿ����ǣ��������ͨ����
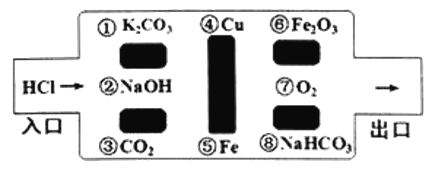
��1������������߳��Թ�������� �� �� �����ڣ����������д����______________
��2���������Ե�������Ļ�ѧ��Ӧ�У������û���Ӧ����________________________���û�ѧ����ʽ��ʾ�������ڸ��ֽⷴӦ����_____����
��3�����������У����������߳���·����������������Թ�����______������ĸ��
A��Ca(OH)2 B��H2SO4 C��CuSO4
���𰸡�����������Fe + 2HCl == FeCl2 + H2��4A
��������
��1������������̼��Ӧ��ͭλ����������ᷴӦ�������ǽ������ʷ�Ӧ�������������������2��һ�ֵ��ʺ�һ�ֻ����ﷴӦ������һ�ֵ��ʺ���һ�ֻ�����ķ�Ӧ���û���Ӧ����Fe + 2HCl = FeCl2 + H2�����û���Ӧ���������������ơ�̼��ء�̼�����ơ�������֮��ķ�Ӧ�Ǹ��ֽⷴӦ������4������3��A���������Ʋ�����������ʷ�Ӧ��ѡ��A����B���������̼��ء��������ơ�������������̼�����Ʒ�Ӧ��ѡ��B��ȷ��C������ͭ�����������ơ�̼��ء�����̼�����Ʒ�Ӧ��ѡ��D��ȷ����ѡA��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڵ�������ܵ�����ǣ� ��
A.Cu
B.NaOH��Һ
C.����Na2CO3
D.�Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO(NH2)2(����)���Ʊ�������̼����������������������ȷ������Ź㷺��Ӧ�á��ش��������⣺

(1)������صļ�����Һ�Ʊ�������װ������ͼ��ʾ��a����________��ͨ��ʱ,������Χ��Һ��pH________(�����С��)�������ĵ缫��ӦʽΪ________��
(2)���غϳ�̼�����������ط�Ӧ��ƽ�ⳣ���Ķ���ֵ���¶ȵĹ�ϵ���£�
(��)2CH3OH(l)+CO(NH2)2(1)![]() CH3OCOOCH3(l)+2NH3(g)��H1
CH3OCOOCH3(l)+2NH3(g)��H1
(��)CH3OH(l)+CO(NH2)2(l)![]() CH3OCONH2(l)+NH3(g)��H2
CH3OCONH2(l)+NH3(g)��H2
(��)CH3OCONH2(l)+CH3OH(l)![]() CH3OCOOCH3(l)+NH3(g)��H3
CH3OCOOCH3(l)+NH3(g)��H3

�١�H1=_______(�á�H2�͡�H3��ʾ);ƽ�ⳣ���Ķ���lnK(��)=________[��lnK(��)��lnK(��)��ʾ]��
�ڶ��ڷ�Ӧ(��),�����¶ȣ���ѧƽ����________(���������桱)��Ӧ�����ƶ���
��Ϊ���CH3OCOOCH3�IJ���,�ɲ�ȡ�Ĵ�ʩ��________________________________(�о�2��)��
(3)����������NaClO2���û����Һ���������������������ú�NO��SO2�Ļ����������ʵ�顣���Һ��NaClO2������������NO��SO2���ѳ��ʹ�ϵ��ͼ��ʾ��

�ٺ�SO2������(��O2)ͨ��������Һ�õ�����Ϊ_________;NO2��������Һ��Ӧ������N2���������������д���÷�Ӧ�Ļ�ѧ����ʽ��_______________________________��
�����ô�������Һ����NO���ѳ��ʽ�ԼΪ15%,˵��NaClO2��������_____________��
��SO2���ѳ������DZ�NO�Ĵ�,��ԭ����____________________________(�о�2��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ1mol��ϩ��������ȫ�����ӳɷ�Ӧ��Ȼ��ʹ�üӳɷ�Ӧ�IJ����������ڹ��������·���ȡ����Ӧ����ȡ����Ӧ���������������������ʵ������Ϊ( )
A.3molB.4molC.5molD.6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������仯����(����)
��ʯ�͵ķ�����ú�ĸ�����ʯ�͵��ѻ��������ȷ�Ӧ��������ϩ�Ʊ�����ϩ��
��������ת��Ϊ����������ϩ�����ʵ���������ʵ�����������ˮ������ȡ��ˮ
A.�٢ڢۢ�B.�٢ڢݢ�
C.�٢��D.�٢ڢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2016���¿α�ȫ������)Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3+(����ɫ)��Cr(OH)4(��ɫ)��Cr2O72(�Ⱥ�ɫ)��CrO42(��ɫ)����ʽ���ڣ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
��1��Cr3+��Al3+�Ļ�ѧ�������ơ���Cr2(SO4)3��Һ����μ���NaOH��Һֱ���������ɹ۲쵽��������_________��
��2��CrO42��Cr2O72����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol![]() L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��
L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��
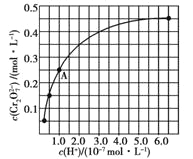
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ____________��
����ͼ��֪����Һ��������CrO42��ƽ��ת����__________(��������������С������������)������A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ__________��
�������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С����÷�Ӧ����H__0(������������С��������������)��
��3���ڻ�ѧ�����в���K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ��Cl������Ag+��CrO42����ש��ɫ������ָʾ����ζ��յ㡣����Һ��Clǡ�ó�����ȫ(Ũ�ȵ���1.0��105 mol��L1)ʱ����Һ��c(Ag+)Ϊ_______ mol![]() L1����ʱ��Һ��c(CrO42)����__________ mol
L1����ʱ��Һ��c(CrO42)����__________ mol![]() L1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010)��
L1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010)��
��4��+6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72��ԭ��Cr3+���÷�Ӧ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��̽���ǻ�ѧѧ�Ƶ���Ҫ������
������������װ��ͼ���ش��й����⣺
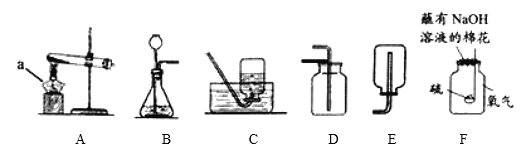
��1��a������������________��
��2������װ��A��ȡ�������䷴Ӧ�Ļ�ѧ����ʽΪ_______________________________������װ��B��ȡ������������©���е����Һ��ҩƷ��__________������װ��D�ռ��������������ķ�����_____________________________��
��3��С����װ��F������������ȼ�յ�ʵ�飬�øĽ�ʵ������ŵ���________________��
���������ᴿ�еõ������������������п��������ʣ�����ֻ��CaCl2һ�֣���Ϊ�õ����������Ȼ��ƣ�ͬѧ���������´�����
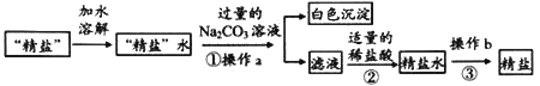
��1������b��������_________��
��2������ټ��������Na2CO3��Һ��Ŀ����________________��
��3������ڷ�Ӧ�Ļ�ѧ����ʽ��___________________________��
��4�����֤����������ں������Na2CO3�ѳ�����_________________________��д��ʵ������������ۣ���
��5������������ģ��������������õ��ľ�������_______����������������С����������������ԭ��������������ԭ����__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����У���ʹˮ�ĵ���ƽ�������ƶ���ʹҺ������Ե���
A. ��ˮ�м���NaHSO4 B. ��ˮ�м���CuSO4
C. ��ˮ�м���Na2CO3 D. ��ˮ���ȵ�100�棬ʹpH��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����л�����������M�ڹ�ҵ����������Ҫ��Ӧ�ã���ϳ�·������;

��A����Է�������Ϊ58,��������������Ϊ0.552,��֪�˴Ź���������ʾΪһ���,�ɷ���������Ӧ

�仯�ش���������:
(1)A������Ϊ_____________,C�к��й���������Ϊ__________________________
(2)F�Ľṹ��ʽΪ________________________________________
(3)B��C�ķ�Ӧ����Ϊ_________________,G��H�ķ�Ӧ����Ϊ____________
(4)F+H��M�Ļ�ѧ����ʽΪ_________________________________________________
(5)�����廯����W������ȡ����,��C��ͬ���칹��,����FeCl3��Һ������ɫ��Ӧ,0.5molW����������Na��Ӧ����1��H2,W����______��ͬ���칹��,���к˴Ź�������Ϊ�����Ľṹ��ʽΪ_______________________
(6)���������ϳ�·��,��C2H4��HOCH2CH2OHΪԭ��(���Լ���ѡ),����Ʊ�![]() �ĺϳ�·��_________________________________________________________________
�ĺϳ�·��_________________________________________________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com