


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
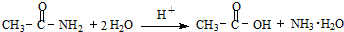
查看答案和解析>>
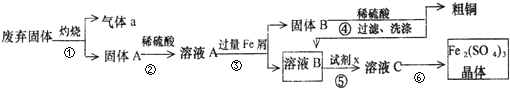
科目:高中化学 来源: 题型:
查看答案和解析>>
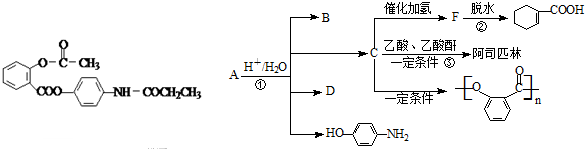
科目:高中化学 来源: 题型:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(SO2)/(mol/L) | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
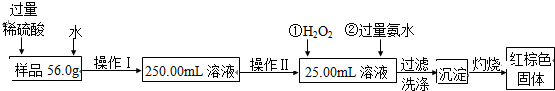
科目:高中化学 来源: 题型:
| A、SO42-的空间构型是正四面体形 |
| B、CS2分子中各原子均达8电子稳定结构 |
| C、CH3COOH分子中碳原子的杂化类型有sp2和sp3两种 |
| D、H2O2分子是既含极性键又含非极性键的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
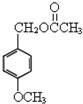 乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图:
乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图: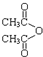 )反应制得.写出反应的化学方程式:
)反应制得.写出反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Na+ | Cl- | NO2- | Mg2+ |
| 浓度(mol/L) | 0.05 | 0.06 | 0.015 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com