
| A、AlCl3 |
| B、FeCl2 |
| C、CuCl2 |
| D、NaCl. |
科目:高中化学 来源: 题型:
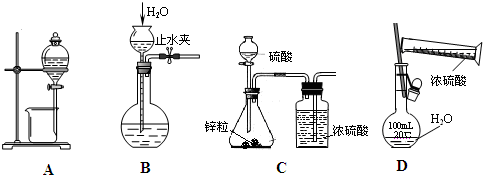
| A、分离酒精和水 |
| B、检查气体发生装置的气密性 |
| C、用Zn粒和稀硫酸制备干燥的H2 |
| D、用浓硫酸配制100mL 1.0mol/L的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
| B、C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
| C、C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
| D、C(Cl-)>C(NH4+)>C(H+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L H2O所含分子数为0.1NA |
| B、常温常压下,500mL 0.1mol/L醋酸溶液中含有分子的总数目为0.05NA |
| C、78g Na2O2固体中Na+的数目为2NA |
| D、5.6g铁与足量盐酸反应转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳的燃烧热大于 110.5kJ/mol |
| B、稀硫酸与浓NaOH溶液反应的中和热为△H=-57.3kJ/mol |
| C、稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3kJ |
| D、①表示2mol C(s)燃烧生成2mol CO(g)需要吸收221kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验内容 | 实验现象 | 实验结论 |
| A | 将几滴水加入蔗糖中并搅拌,再加入浓硫酸,迅速搅拌 | 蔗糖逐渐变黑,体积膨胀,有刺激性气味气体生成 | 只体现了浓硫酸的脱水性 |
| B | 将铜片放入浓硝酸中 | 产生大量无色气体,溶液变为蓝绿色 | 只体现了浓硝酸的强氧化性 |
| C | 溴乙烷和氢氧化钠溶液充分反应,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色 | 苯与溴发生了取代反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
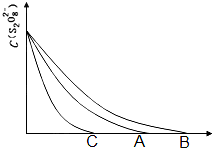 碘在科研与生活中有重要应用.
碘在科研与生活中有重要应用.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| J | ||||
| R |
| I1 | I2 | I3 | I4 | … | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com