
| 20.02mL+19.98mL |
| 2 |
| 0.56g |
| 5g |
| 20.02mL+19.98mL |
| 2 |
| 0.56g |
| 5g |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、若m+n<p,温度不变,将容器体积缩小到原来的一半,则X的浓度大于原来的2倍 |
| B、若在密闭恒温容器中加入pmol的Z达到平衡,再加入一定量的Z,Z的百分比含量不变,则m+n=p |
C、若定温下Y的体积分数(Y%)与压强变化的关系如图所示,则a点表示平衡正向移动且反应速率:a点<b点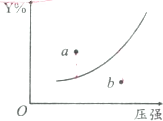 |
| D、若m+n=p,且在密闭恒容容器内进行,当温度升高时,平衡逆向移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.| 序号 | V(H2SO4)/ml | C(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、F2 K HCl |
| B、Cl2 Al H2 |
| C、NO2 Na Br2 |
| D、O2 SO2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NO3ˉ、Fe2+、Clˉ |
| B、SO42-、Mg2+、Clˉ、Na+ |
| C、SO42-、Na+、Mg2+、CH3COOˉ |
| D、Clˉ、SCNˉ、K+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
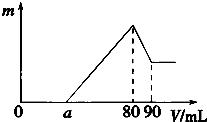 一定质量的镁、铝混合物投到2mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol?L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
一定质量的镁、铝混合物投到2mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol?L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| B、向 NaHSO4溶液中滴加Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ |
| D、用烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com