
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质。某小组在实验室中用浸出-萃取法制备硫酸铜:

(1)操作Ⅰ为________。操作Ⅱ用到的玻璃仪器有烧杯、________。
(2)操作Ⅱ、操作Ⅲ的主要目的是________、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80 ℃、200 ℃、300 ℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2 mol·L-1 盐酸、1 mol·L-1 H2SO4、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1 BaCl2溶液、蒸馏水。仪器和用品自选。
实验步骤 | 预期现象和结论 |
步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,______________________ | ____________,说明悬浊液中混有Cu4(OH)6SO4 |
步骤2:另取少量悬浊液于试管中,____________________ | ____________,说明悬浊液中混有Cu(OH)2 |
(4)上述实验需要100 mL 0.5 mol·L-1的CuSO4溶液,配制时需称取________g CuSO4·5H2O(相对分子质量:250)。
(1)过滤 分液漏斗
(2)除去杂质
(3)
实验步骤 | 预期现象和结论 |
加入过量2 mol·L-1盐酸,充分振荡,再滴加几滴0.1 mol·L-1 BaCl2溶液 | 有白色沉淀生成 |
将试管放入装有沸水的小烧杯中水浴加热一段时间,取出试管观察 | 试管中有黑色固体生成 |
(4)12.5
【解析】 (1)由流程图可知操作Ⅰ是固、液分离,是过滤;操作Ⅱ是液液分离,且互不相溶,是分液,用到分液漏斗。(2)操作Ⅱ、Ⅲ的目的主要是除杂。
步骤1,由信息中三种物质均难溶于水,可溶于酸,故加入过量盐酸使之溶解,再用BaCl2溶液检验有无SO42—即可。步骤2,检验有无Cu(OH)2,可利用信息中三种物质分解温度不同,可在80 ℃时看有无分解产生CuO,若有,则有Cu(OH)2。(4)配制溶液需CuSO4的物质的量为0.1 L×0.5 mol·L-1=0.05 mol,即需要0.05 mol CuSO4·5H2O,其质量m=0.05 mol×250 g
·mol-1=12.5 g。


科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题5化学反应与能量变化练习卷(解析版) 题型:选择题
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )。
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1
C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1
D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题2常用化学计量--物质的量练习卷(解析版) 题型:选择题
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )。
A.3.2 g B.4.0 g C.4.2 g D.4.6 g
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题1物质的组成分类性质及化学用语练习卷(解析版) 题型:选择题
类比归纳是学习化学的重要方法,以下类比的说法正确的是( )。
A.CO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色
B.MgO、Al2O3都是高熔点离子化合物,熔化时都能导电
C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似
D.CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题1物质的组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列有关物质组成、性质和变化的说法中,正确的是( )。
A.化学变化不产生新元素,产生新元素的变化不是化学变化
B.石油的分馏、裂化、裂解和煤的干馏都属于化学变化
C.导电性属于物质的物理性质,所以物质导电时不可能发生化学变化
D.某微粒的电子数等于质子数,则该微粒可能是分子或离子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题13化学实验综合应用练习卷(解析版) 题型:实验题
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:

[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
一 | 6.4 | 2.56 | 448 |
二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:______________________________________________;
第二小组:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
下列关于溶液中所含离子的检验结论正确的是( )。
A.加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在
B.欲鉴别FeCl2溶液、AlCl3溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水
C.加入盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32—存在
D.加入BaCl2溶液生成白色沉淀,再加足量盐酸沉淀不溶解,则原溶液中一定有SO42—存在
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题11有机化学基础练习卷(解析版) 题型:填空题
Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ和Ⅳ。

化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
CH3—CH==CH—CH2—CH3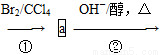 CH2==CH—CH==CH—CH3
CH2==CH—CH==CH—CH3
(1)a的结构简式是________________;②的反应类型是____________。
(2)写出反应①的化学方程式________________,该反应类型是________。
(3)①用甲醇与某有机物发生酯化反应可合成化合物Ⅱ,写出该反应的化学方程式________________________________________________________。
②化合物Ⅱ与新制的氢氧化铜悬浊液反应的化学反应方程式为___________。
(4)化合物Ⅳ是Ⅲ的同分异构体,也有同样的六元环,Ⅳ的结构简式为______。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 基本概念、基本理论练习卷(解析版) 题型:填空题
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源。
(1)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为______________________。

(2)煤气化所得气体可用于工业合成二甲醚,其反应如下:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
同时发生副反应:CO(g)+2H2(g) CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
在温度为250 ℃、压强为3.0 MPa时,某工厂按投料比V(H2)∶V(CO) =a进行生产,平衡时反应体系中各组分的体积分数如下表:
物质 | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
①投料比a=________;
②250℃时反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=________。
CO2(g)+H2(g)的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com