
Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ和Ⅳ。

化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
CH3—CH==CH—CH2—CH3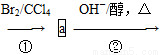 CH2==CH—CH==CH—CH3
CH2==CH—CH==CH—CH3
(1)a的结构简式是________________;②的反应类型是____________。
(2)写出反应①的化学方程式________________,该反应类型是________。
(3)①用甲醇与某有机物发生酯化反应可合成化合物Ⅱ,写出该反应的化学方程式________________________________________________________。
②化合物Ⅱ与新制的氢氧化铜悬浊液反应的化学反应方程式为___________。
(4)化合物Ⅳ是Ⅲ的同分异构体,也有同样的六元环,Ⅳ的结构简式为______。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题3中学化学常见的两种重要反应类型练习卷(解析版) 题型:选择题
下面4组物质,能起反应,且既属于离子反应,又属于氧化还原反应的是 ( )
A.Na2SO4溶液和BaCl2溶液
B.铝片与Hg(NO3)2溶液
C.稀硫酸与铜片
D.NaNO3溶液与KCl溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题13化学实验综合应用练习卷(解析版) 题型:实验题
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质。某小组在实验室中用浸出-萃取法制备硫酸铜:

(1)操作Ⅰ为________。操作Ⅱ用到的玻璃仪器有烧杯、________。
(2)操作Ⅱ、操作Ⅲ的主要目的是________、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80 ℃、200 ℃、300 ℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2 mol·L-1 盐酸、1 mol·L-1 H2SO4、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1 BaCl2溶液、蒸馏水。仪器和用品自选。
实验步骤 | 预期现象和结论 |
步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,______________________ | ____________,说明悬浊液中混有Cu4(OH)6SO4 |
步骤2:另取少量悬浊液于试管中,____________________ | ____________,说明悬浊液中混有Cu(OH)2 |
(4)上述实验需要100 mL 0.5 mol·L-1的CuSO4溶液,配制时需称取________g CuSO4·5H2O(相对分子质量:250)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
实验是化学研究的基础,下列各图所示的实验方法、装置或操作正确的是 ( )

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
欲鉴别物质的量浓度都为0.1 mol·L-1的KCl、(NH4)2SO4、NH3·H2O和H2SO4四瓶无色溶液,下列实验方案最佳的是( )。
A.用pH试纸鉴别
B.分别用闻气味和pH试纸鉴别
C.分别用BaCl2和NaOH溶液鉴别
D.用Ba(OH)2溶液鉴别
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题11有机化学基础练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.乙炔和苯均为不饱和烃,都只能发生加成反应
B.加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖
C.油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂
D.向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:填空题
)已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)

(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为
_________________________________________________________________
________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adebC.abcbd D.abd
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 有机推断练习卷(解析版) 题型:推断题
某吸水材料与聚酯纤维都是重要的化工原料。它们的合成路线如图所示:

已知: ①A由C、H、O三种元素组成,相对分子质量为32。
②RCOOR′+R″OH RCOOR″+R′OH(R、R′、R″代表烃基)。
RCOOR″+R′OH(R、R′、R″代表烃基)。
请回答下列问题:
(1)A的结构简式是____________________。
(2)B中的官能团名称是______________________。
(3)D→E的反应类型是______________。
(4)①乙酸与化合物M反应的化学方程式是_________________________________
②G→聚酯纤维的化学方程式是____________________________
(5)E的名称是___________。
(6)G的同分异构体有多种,满足下列条件的共有_____种。
①苯环上只有两个取代基;
②1 mol该物质与足量的NaHCO3溶液反应生成2 mol CO2。
(7)写出由 合成
合成 的流程图(注明反应条件)。
的流程图(注明反应条件)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:计算题
我国是个钢铁大国,钢铁产量居世界第一位,高炉炼铁是最为普遍的炼铁方法。某种矿石中铁元素以氧化物FemOn的形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
(1)计算该铁矿石中铁元素的质量分数。
(2)计算氧化物FemOn的化学式(m、n为正整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com