
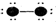
分析 (1)先判断元素,再根据小黑点、短线表示含义书写确定化学式确定分子种类;
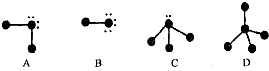
(2)先判断分子的空间构型,找出呈正四面体的分子,然后比较分子的稳定性,分子的沸点与分子间作用力有关,分子间存在氢键的分子其熔沸点相应升高;
(3)由阴阳离子构成的化合物是离子化合物.
解答 解:(1)A.中心原子有2个孤电子对2个共用电子对,所以是O或S元素,配原子只有1个共用电子对,所以是H元素,故化学式为H2O或H2S;
B.中心原子有3个孤电子对1个共用电子对,所以是F或Cl元素,配原子只有1个共用电子对,所以是H元素,故化学式为HF或HCl;
C.中心原子有1个孤电子对3个共用电子对,所以是N或P元素,配原子只有1个共用电子对,所以是H元素,故化学式为NH3或PH3;
D.中心原子有4个共用电子对,所以是C元素,配原子只有1个共用电子对,所以是H元素,故化学式为CH4或SiH4,;
所以A、B、C、D四种“图示”中,所表示的物质可分为四组共8种,
故答案为:8;
(2)H2O、H2S分子构型为V型,HF、HCl分子构型为直线型,NH3、PH3分子构型为三角锥型,CH4、SiH4分子构型为正四面体型,C、Si属于同一主族,其氢化物稳定性随其中心元素的非金属性从上往下依次减弱,所以物质的稳定性顺序是CH4>SiH4,H2O、HF、NH3分子间存在氢键,而CH4或SiH4没有氢键,所以它们沸点的变化与其余各组相比不相同,
故答案为:CH4>SiH4;不相同;其它各组中存在氢键;
(3)上述8种物质中,氨气和氯化氢反应NH3+HCl=NH4Cl,生成的氯化铵为铵根离子和氯离子构成的盐,属于离子化合物,
故答案为:NH3+HCl=NH4Cl.
点评 本题考查了原子最外层电子和电键图的关系,只有知道小黑点、短线表示含义结合题意才能准确判断元素,从而写出化学式,根据化学式结合物质结构有关知识分析是解答关键,注意氢键对熔沸点的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键只存在于分子内,分子间作用力只存在于分子间 | |
| B. | 冰变为液态水时,共价键没有被破坏 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 物质在溶于水的过程中,化学键一定会被破坏或改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C能将食物中的Fe3+转化为易吸收的Fe2+,是因为维C有氧化性 | |
| B. | SO2、NO2等在大气中达到一定浓度造成大气污染.溶液的稳定性决定了污染的长期性 | |
| C. | 燃料电池能有效提高能源的利用率是因为通过原电池装置将热能直接转化成了电能 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行有效治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
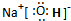 ,所含有的化学键有离子键、共价键;它属于离子化合物(填“离子”或“共价”).
,所含有的化学键有离子键、共价键;它属于离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Cl?、HCO3? | B. | Na+、NO3-、SO42-、I? | ||
| C. | Na+、Mg2+、Cl?、SO42- | D. | Fe3+、K+、Cl?、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了保护环境,节约资源,不使用一次性筷子、纸杯、塑料袋等 | |
| B. | 为了提高肥效、收割小麦、玉米等作物后将秸秆及时焚烧 | |
| C. | 为了提高农作物的产量和质量,应大量使用化肥和农药 | |
| D. | 为了防止干电池造成环境污染,应将废旧电池深埋处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com