
【题目】按要求书写方程式:
(1)过氧化钠与CO2反应的化学方程式:
(2)将少量偏铝酸钠溶液滴入足量盐酸的离子方程式:
(3)铁与高温水蒸气反应的化学方程式:
(4)镁条在二氧化碳中燃烧的化学方程式: .
【答案】
(1)2Na2O2+2CO2=2Na2CO3+O2
(2)AlO2﹣+4H+=Al3++2H2O
(3)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
(4)2Mg+CO2 ![]() 2MgO+C
2MgO+C
【解析】解:(1)过氧化钠与CO2反应生成碳酸钠和氧气,即:2Na2O2+2CO2=2Na2CO3+O2 , 所以答案是:2Na2O2+2CO2=2Na2CO3+O2;(2)将少量偏铝酸钠溶液滴入足量盐酸,会产生氯化铝溶液,反应的离子方程式为:AlO2﹣+4H+=Al3++2H2O,所以答案是:AlO2﹣+4H+=Al3++2H2O;(3)铁与高温水蒸气反应生成四氧化三铁和氢气,即3Fe+4H2O(g) ![]() Fe3O4+4H2 , 所以答案是:3Fe+4H2O(g)
Fe3O4+4H2 , 所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2;(4)镁条在二氧化碳中燃烧生成氧化镁和碳,即2Mg+CO2
Fe3O4+4H2;(4)镁条在二氧化碳中燃烧生成氧化镁和碳,即2Mg+CO2 ![]() 2MgO+C,所以答案是:2Mg+CO2
2MgO+C,所以答案是:2Mg+CO2 ![]() 2MgO+C.
2MgO+C.


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
B.常温常压下,18 g H2O 中含有的原子总数为3NA
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA
D.1 mol Cl2与1 mol Fe反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )![]()

A.在pH<4.76的溶液中,c(CH3COOˉ)<c(CH3COOH)
B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COOˉ)=1.0
C.在pH>4.76的溶液中,c(CH3COOˉ)与c(OHˉ)之和可大于c(H+)
D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COOˉ)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅属于酸性氧化物,理由是
A. Si是非金属元素 B. SiO2对应的水化物是可溶性弱酸
C. SiO2与强碱反应生成盐和水 D. SiO2不能与酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面两种方法均可制得Fe(OH)2白色沉淀.
(1)方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.①用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 .
②除去蒸馏水中溶解的O2常采用的方法.
③制取Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是:防止发生反应 . (填化学方程式)
(2)方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
①在试管Ⅰ里加入的试剂是 .
②为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和盐类水解无关的是
A. 热的纯碱溶液去油污能力强 B. 用饱和FeCl3溶液制备Fe (OH)3胶体
C. NaHSO4水溶液显酸性 D. 施肥时,草木灰和铵态氮肥不能混合施用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34,.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是2CH3CH2OH ![]() CH3CH2﹣O﹣CH2CH3(乙醚)+H2O
CH3CH2﹣O﹣CH2CH3(乙醚)+H2O
实验步骤:
Ⅰ.乙醚的制备
在分液漏斗中加入2mL 95%的乙醇,在一干燥的三颈烧瓶中放入12mL 95%的乙醇,在冷水浴中的冷却下边摇动边缓慢加入12mL浓硫酸,使混合均匀,并加入2粒沸石.实验装置如图:将反应瓶放在电热套上加热,使温度迅速地上升到140℃,开始由分液漏斗慢慢滴加乙醇,控制流速并保持温度在135~140℃之间.待乙醇加完后,继续反应10min,直到温度上升到160℃止.关闭热源,停止反应.
Ⅱ.乙醚的精制
将馏出物倒入分液漏斗中,依次用8mL 15% NaOH溶液、8mL饱和食盐水洗涤,最后再用8mL饱和氯化钙溶液洗涤2次,充分静置后分液.将乙醚倒入干燥的锥形瓶中,用块状无水氯化钙干燥.待乙醚干燥后,加入到蒸馏装置中用热水浴蒸馏,收集33~38℃的馏分.
请根据上述信息,完成下列问题: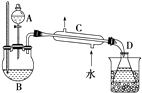
(1)乙醚的制备和精制过程中都需要使用沸石,其作用是 , 如果实验中忘记加沸石,需要怎么处理? .
(2)乙醚的制备和精制过程中都需要使用温度计,其水银球位置是否相同?(填“是”或“否”),原因是
(3)仪器C的名称为 .
(4)如果温度太高,将会发生副反应,产物是 .
(5)精制乙醚中,加入15% NaOH溶液的作用是 , 加入饱和氯化钙溶液的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是最常见的一次电池,它的总反应如下:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH由此可知,该电池放电时的负极材料是( )
A.Zn
B.Zn(OH)2
C.MnO2
D.MnOOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com