
 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.分析 (1)根据化合物中元素的化合价的代数和为零计算;根据As的化合价判断生成硫酸盐的化学式;NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解;HAsO32-在溶液中电离程度小于水解程度;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫;As2O3与锌、硫酸混合反应生成AsH3和硫酸锌、水;
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,根据化合价的变化分析;
(3)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=$\frac{c({H}_{2}As{{O}_{4}}^{-})c({H}^{+})}{c({H}_{3}AS{O}_{4})}$,以第一步电离为主;
②电池总反应为AsO43-+2I-+H2O?AsO33-+I2+2OH.当P池中溶液由无色变成蓝色时,说明P池发生的是负极氧化反应,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,据此可写出电极反应方程式,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,电子应由负极流向正极.
解答 解:(1)H3AsO3中O为-2价,H为+1价,As的化合价为+3价;As的化合价为+3价,硫酸根离子的化合价为-2价,则硫酸盐的化学式As2(SO4)3;NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解,其水解方程式为:;HAsO32-在溶液中电离程度小于水解程度,以水解为主,水解生成H2AsO3-,则该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:+3;As2(SO4)3;HAsO32-+H2O?H2AsO3-+OH-;>;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫,反应的化学方程式为:As4S4+7O2$\frac{\underline{\;高温\;}}{\;}$2As2O3+4SO2;As2O3与锌、硫酸混合反应生成AsH3和硫酸锌、水,其反应的方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O;
故答案为:As4S4+7O2$\frac{\underline{\;高温\;}}{\;}$2As2O3+4SO2;As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O;
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,As的化合价从+3价升高到+5价,S的化合价从-2价升高到0价,N的化合价从+5价降低到+4价,则反应中还原剂与氧化剂物质的量之比为1:10;
故答案为:1:10;
(3)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=$\frac{c({H}_{2}As{{O}_{4}}^{-})c({H}^{+})}{c({H}_{3}AS{O}_{4})}$,以第一步电离为主,则c(H+)≈$\sqrt{{K}_{1}×c({H}_{3}AS{O}_{4})}$=$\sqrt{6×1{0}^{-3}×0.6}$=0.06mol/L;
故答案为:0.06;
②P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出;
故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
点评 本题以As及其化合物的性质为知识背景,涉及水解平衡与电离平衡、氧化还原反应的分析与计算、原电池原理及平衡的移动等,属基础考综合应用的考查,难度中等,对提高学生分析问题解决问题的能力培养有一定帮助.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 20 | 40 | 100 | 120 |
| 沉淀质量/g | 0 | 0.233 | m | 0.699 | 0.699 |
| A. | 混合前,Na2SO4溶液的物质的量浓度为0.05mol/L | |
| B. | 混合前,BaCl2溶液的物质的量浓度为0.10mol/L | |
| C. | 3号实验中沉淀的质量m为0.398g | |
| D. | 完全沉淀60mLNa2SO4溶液消耗BaCl2溶液的体积为80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
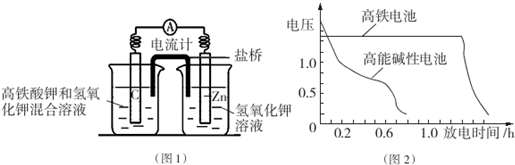
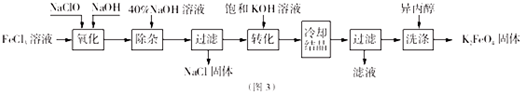
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
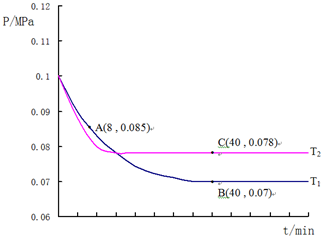
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3 | |
| B. | 为了使馒头、银耳等洁白、卖相好,可以用点燃硫磺法熏蒸它们 | |
| C. | 可以用SO2来漂白纸浆、毛、丝、草帽辫等 | |
| D. | “硫磺”温泉可以医治皮肤病 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com