
| A. | 检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3 | |
| B. | 为了使馒头、银耳等洁白、卖相好,可以用点燃硫磺法熏蒸它们 | |
| C. | 可以用SO2来漂白纸浆、毛、丝、草帽辫等 | |
| D. | “硫磺”温泉可以医治皮肤病 |
分析 A.碳酸钡能够溶于盐酸,生成氯化钡,钡离子为重金属,有毒;
B.二氧化硫有毒,不能用来漂白食品;
C.依据二氧化硫具有漂白性解答;
D.含硫量较高的温泉,能够杀菌消毒.
解答 解:A.BaCO3易与胃酸反应生成BaCl2,BaCl2是重金属盐,能使蛋白质变性而使人中毒,故A正确;
B.二氧化硫有毒,不能用SO2熏蒸食品,食用用SO2熏蒸的食品,对人体的肝、肾脏等有严重损害,故B错误;
C.二氧化硫具有漂白性,可以用SO2来漂白纸浆、毛、丝、草帽辫等,故C正确;
D.含硫量较高的温泉,能够杀菌消毒,可以医治皮肤病,故D正确;
故选:B.
点评 本题考查了生活中常用的化学知识,熟悉相关物质的性质是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
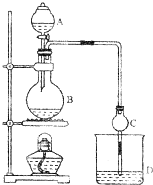 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | p=$\frac{17V+22400}{22.422.4V}$ | B. | W=$\frac{17c}{ρ}$ | ||
| C. | $\frac{17V}{17V+22400}$=W | D. | C=$\frac{1000Vρ}{17V+22400}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com