
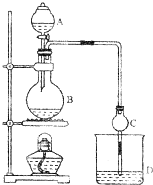
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.分析 (1)根据乙酸与乙醇在加热、浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(2)球形干燥管的管口伸入液面下可以防止倒吸,同时起冷凝的作用;
便于分层得到酯,故D中的溶液为饱和的碳酸钠溶液,碳酸根是弱酸的酸根离子能水解,溶液呈碱性,反应后溶液分层,上层无色油体液体,由于碳酸钠与乙酸反应,故下层溶液颜色变;
(3)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,反应掉挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯.
解答 解:(1)乙酸与乙醇在加热、浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,该反应为可逆反应,方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,则浓硫酸的作用为催化剂、吸水剂;
故答案为:催化剂、吸水剂;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)球形干燥管的管口伸入液面下可以防止倒吸,同时起冷凝的作用;
故答案为:防止倒吸、冷凝;
(3)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,反应掉挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:ABC.
点评 本题考查乙酸乙酯的制备,难度中等,注意掌握乙酸乙酯的制取原理及装置选择,明确反应过程中浓硫酸、饱和碳酸钠溶液的作用.


科目:高中化学 来源: 题型:推断题
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
 ;
; NH4++NH2-.
NH4++NH2-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3 | |
| B. | 为了使馒头、银耳等洁白、卖相好,可以用点燃硫磺法熏蒸它们 | |
| C. | 可以用SO2来漂白纸浆、毛、丝、草帽辫等 | |
| D. | “硫磺”温泉可以医治皮肤病 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{m}{VM}$ | B. | m=ρVM | C. | W%=$\frac{cM}{1000p}$% | D. | c=$\frac{1000ρW%}{M}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 杂质 | 加入试剂 | 化学方程式 |
| 硫酸盐 | ||
| MgCl2 | ||
| CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点/℃ | 沸点/℃ | 水溶性 |
| (CN)2 | -34 | -21.2 | 可溶 |
| Cl2 | -101 | -34 | 可溶 |
| A. | 二者均为非金属单质 | |
| B. | 标况下,氰的体积大于氯气的体积 | |
| C. | 同温同压下,相同质量的氰和氯气,前者含有的原子多 | |
| D. | 标况下,氰与氯气的密度之比为71:52 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com