
ЁОЬтФПЁПЕтМАЦфЛЏКЯЮядкЩњВњЁЂЩњЛюКЭПЦММЕШЗНУцЖМгазХживЊЕФгІгУЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЕтВЛвЫШмгкЫЎЃЌЕЋвзШмгкЕтЛЏМиШмвКВЂЩњГЩЖрЕтРызгЃЌЗДгІШчЯТЃК
ЂйI2ЃЈsЃЉ+I-ЃЈaqЃЉ![]() I3-ЃЈaqЃЉЁїH<0ЃЛЂкI2ЃЈsЃЉ+2I-ЃЈaqЃЉ
I3-ЃЈaqЃЉЁїH<0ЃЛЂкI2ЃЈsЃЉ+2I-ЃЈaqЃЉ![]() I42-ЃЈaqЃЉ
I42-ЃЈaqЃЉ
ЗДгІЂкЕФЦНКтГЃЪ§ЕФБэДяЪНЮЊK=____________ЁЃЮТЖШЩ§ИпЪБЃЌЗДгІЂйЕФЦНКтГЃЪ§НЋ____________ЃЈЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉ
ЃЈ2ЃЉЕтгыЮйдквЛЖЈЮТЖШЯТЃЌПЩЗЂЩњШчЯТПЩФцЗДгІЃКWЃЈsЃЉ+I2ЃЈgЃЉ![]() WI2ЃЈgЃЉЯжзМШЗГЦШЁ0.508gЕтКЭ0.736gН№ЪєЮйЗХжУгк50.0mLЕФУмБеШнЦїжаЃЌВЂМгШШЪЙЦфЗДгІЁЃШчЭМЪЧЛьКЯЦјЬхжаЕФWI2еєЦјЕФЮяжЪЕФСПЫцЪБМфБфЛЏЙиЯЕЕФЭМЯѓ[nЃЈWI2ЃЉЁЋt]ЃЌЦфжаЧњЯпЂёЃЈ0ЁЋt2ЪБМфЖЮЃЉЕФЗДгІЮТЖШЮЊ450ЁцЃЌЧњЯпЂђЃЈДгt2ЪБПЬПЊЪМЃЉЕФЗДгІЮТЖШЮЊ530Ёц
WI2ЃЈgЃЉЯжзМШЗГЦШЁ0.508gЕтКЭ0.736gН№ЪєЮйЗХжУгк50.0mLЕФУмБеШнЦїжаЃЌВЂМгШШЪЙЦфЗДгІЁЃШчЭМЪЧЛьКЯЦјЬхжаЕФWI2еєЦјЕФЮяжЪЕФСПЫцЪБМфБфЛЏЙиЯЕЕФЭМЯѓ[nЃЈWI2ЃЉЁЋt]ЃЌЦфжаЧњЯпЂёЃЈ0ЁЋt2ЪБМфЖЮЃЉЕФЗДгІЮТЖШЮЊ450ЁцЃЌЧњЯпЂђЃЈДгt2ЪБПЬПЊЪМЃЉЕФЗДгІЮТЖШЮЊ530Ёц

ЂйИУЗДгІЁїH_________0ЃЈЬюЁА>ЁБЛђЁА<ЁБЃЉЁЃ
ЂкЗДгІДгПЊЪМЕНt1ЃЈt1=3minЃЉЪБМфФкЕФЦНОљЫйТЪvЃЈI2ЃЉ= ____________
Ђлдк450ЁцЪБЃЌИУЗДгІЕФЦНКтГЃЪ§K=____________ЁЃ
ЂмФмЙЛЫЕУїЩЯЪіЗДгІвбОДяЕНЦНКтзДЬЌЕФга____________ ЃЈЬюбЁЯюзжФИЃЉ
A.I2гыWI2ЕФХЈЖШЯрЕШ
B.ЕЅЮЛЪБМфФкЃЌН№ЪєЮйЯћКФЕФЮяжЪЕФСПгыЕЅжЪЕтЩњГЩЕФЮяжЪЕФСПЯрЕШ
C.ШнЦїФкЛьКЯЦјЬхЕФУмЖШВЛдйИФБф
D.ШнЦїФкЦјЬхбЙЧПВЛЗЂЩњБфЛЏ
ЃЈ3ЃЉI2O5ЪЧАзЩЋЗлФЉзДЙЬЬхЃЌПЩгУзїбѕЛЏМСЪЙH2SЁЂCOЁЂHC1ЕШбѕЛЏЃЌдкКЯГЩАБЙЄвЕжаГЃгУI2O5РДЖЈСПВтСПCOЕФКЌСПЁЃ
вбжЊЃКЂй2I2ЃЈsЃЉ+5O2ЃЈgЃЉЃН2I2O5ЃЈsЃЉІЄHЃН-75.56kJmol-1
Ђк2COЃЈgЃЉ+O2ЃЈgЃЉЃН2CO2ЃЈgЃЉІЄHЃН-566.0kJmol-1ЁЃ
аДГіCOЃЈgЃЉгыI2O5ЃЈsЃЉЗДгІЮіГіЙЬЬЌI2ЕФШШЛЏбЇЗНГЬЪНЃК_____________________ЁЃ
ЁОД№АИЁП
ЃЈ1ЃЉcЃЈI42-ЃЉ/c2ЃЈI-ЃЉЃЛМѕаЁЃЛ
ЃЈ2ЃЉЂй<ЃЛЂк0.012molЁЄL-1ЁЄmin-1ЃЛЂл9ЃЛЂмBCЃЛ
ЃЈ3ЃЉ5COЃЈgЃЉ+I2O5ЃЈsЃЉ=5CO2ЃЈgЃЉ+I2ЃЈsЃЉЁїH=ЁЊ1377.22kJ/mol
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉвбжЊЗНГЬЪНI2ЃЈsЃЉ+2I-ЃЈaqЃЉI42-ЃЌдђЦфЦНКтГЃЪ§БэДяЪНЮЊЃКK=![]() ЃЛвбжЊЗДгІЂйЕФЁїHЃМ0ЃЌЫљвдЩ§ИпЮТЖШЦНКтЯђФцЗНЯђвЦЖЏЃЌдђЦНКтГЃЪ§МѕаЁЃЌЙЪД№АИЮЊЃК
ЃЛвбжЊЗДгІЂйЕФЁїHЃМ0ЃЌЫљвдЩ§ИпЮТЖШЦНКтЯђФцЗНЯђвЦЖЏЃЌдђЦНКтГЃЪ§МѕаЁЃЌЙЪД№АИЮЊЃК![]() ЃЛМѕаЁЃЛ
ЃЛМѕаЁЃЛ
ЃЈ2ЃЉЂйЃЈ1ЃЉЩ§ИпЮТЖШЃЌЛЏбЇЦНКтЯђЮќШШЗНЯђвЦЖЏЃЛЩ§ИпЮТЖШЪБЃЌWI2ЕФЮяжЪЕФСПМѕЩйЃЌЫљвдИУЗДгІЯђФцЗДгІЗНЯђвЦЖЏЃЌМДФцЗДгІЪЧЮќШШЗДгІЃЌЫљвде§ЗДгІЪЧЗХШШЗДгІЃЌЁїHЃМ0ЃЌЙЪД№АИЮЊЃКЃМЃЛ
ЂквђЮЊvЃЈWI2ЃЉ=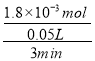 =1.20ЁС10-2 molL-1min-1ЃЛгЩгкЗДгІЫйТЪжЎБШЕШгкМЦСПЪ§жЎБШЃЌЫљвдvЃЈI2ЃЉ=1.20ЁС10-2molL-1min-1ЃЌЙЪД№АИЮЊЃК1.20ЁС10-2molL-1min-1ЃЛ
=1.20ЁС10-2 molL-1min-1ЃЛгЩгкЗДгІЫйТЪжЎБШЕШгкМЦСПЪ§жЎБШЃЌЫљвдvЃЈI2ЃЉ=1.20ЁС10-2molL-1min-1ЃЌЙЪД№АИЮЊЃК1.20ЁС10-2molL-1min-1ЃЛ
ЂлЗДгІПЊЪМЪБЃЌЕтЕФЮяжЪЕФСПЮЊn=![]() =0.002molЃЌЗДгІДяЦНКтЪБЩњГЩWI21.80ЁС10-3molЃЌИљОнЛЏбЇЗНГЬЪНПЩжЊЃЌашвЊЕт1.80ЁС10-3molВЮМгЗДгІЃЌЪЃгрЕт0.0002molЃЌЫљвдЦНКтЪБЃЌcЃЈWI2ЃЉ=
=0.002molЃЌЗДгІДяЦНКтЪБЩњГЩWI21.80ЁС10-3molЃЌИљОнЛЏбЇЗНГЬЪНПЩжЊЃЌашвЊЕт1.80ЁС10-3molВЮМгЗДгІЃЌЪЃгрЕт0.0002molЃЌЫљвдЦНКтЪБЃЌcЃЈWI2ЃЉ=![]() =3.6ЁС10-2mol/LЃЌcЃЈI2ЃЉ=
=3.6ЁС10-2mol/LЃЌcЃЈI2ЃЉ=![]() =0.004mol/LЃЌвђЮЊWЪЧЙЬЬхЃЌЫљвдK=
=0.004mol/LЃЌвђЮЊWЪЧЙЬЬхЃЌЫљвдK=![]() =9ЃЌЙЪД№АИЮЊЃК9ЃЛ
=9ЃЌЙЪД№АИЮЊЃК9ЃЛ
ЂмЗДгІДяЕНЦНКтзДЬЌЪБЃЌе§ФцЗДгІЫйТЪЯрЕШЃЌЦНКтЪБИїжжЮяжЪЕФЮяжЪЕФСПЁЂХЈЖШЕШВЛдйЗЂЩњБфЛЏЁЃAЁЂЗДгІДяЦНКтЪБЃЌI2гыWI2ЕФХЈЖШПЩФмЯрЕШвВПЩФмВЛЕШЃЌгыЗДгІГѕЪМХЈЖШМАзЊЛЏТЪгаЙиЃЌЫљвдВЛФмжЄУїДяЕНЦНКтзДЬЌЃЌЙЪAДэЮѓЃЛBЁЂЕЅЮЛЪБМфФкЃЌН№ЪєЮйЯћКФЕФЮяжЪЕФСПгыЕЅжЪЕтЩњГЩЕФЮяжЪЕФСПЯрЕШЃЌИУЗДгІЕФе§ФцЗДгІЫйТЪЯрЕШЃЌЫљвдДяЕНЦНКтзДЬЌЃЌЙЪBе§ШЗЃЛCЁЂЦНКтЪБИїжжЮяжЪЕФЮяжЪЕФСПЃЌМДжЪСПвВВЛБфЃЌШнЦїЕФЬхЛ§ВЛБфЃЌЫљвдУмЖШВЛдйБфЛЏЃЌЙЪCе§ШЗЃЛDЁЂИУЗДгІЪЧЗДгІЧАКѓЦјЬхЬхЛ§ВЛБфЕФЗДгІЃЌЮоТлЗДгІЪЧЗёДяЕНЦНКтзДЬЌЃЌбЙЧПЪМжеВЛБфЃЌЙЪDДэЮѓЃЛЙЪД№АИЮЊЃКBCЃЛ
ЃЈ3ЃЉвбжЊШШЛЏбЇЗНГЬЪНЃКЂй2I2ЃЈsЃЉ+5O2ЃЈgЃЉ=2I2O5ЃЈsЃЉЃЛЁїH=-75.56kJmol-1ЃЌЂк2COЃЈgЃЉ+O2ЃЈgЃЉ=2CO2ЃЈgЃЉЃЛЁїH=-566.0kJmol-1ЃЌИљОнИЧЫЙЖЈТЩНЋЗНГЬЪНЂкЁС![]() -ЂйЁС
-ЂйЁС![]() ЕУ5COЃЈgЃЉ+I2O5ЃЈsЃЉ=5CO2ЃЈgЃЉ+I2ЃЈsЃЉЃЛЁїH=ЃЈ-566.0kJmol-1ЃЉЁС
ЕУ5COЃЈgЃЉ+I2O5ЃЈsЃЉ=5CO2ЃЈgЃЉ+I2ЃЈsЃЉЃЛЁїH=ЃЈ-566.0kJmol-1ЃЉЁС![]() -ЃЈ-75.56kJmol-1ЃЉЁС
-ЃЈ-75.56kJmol-1ЃЉЁС![]() =-1377.22kJ/molЃЌЫљвдЦфШШЛЏбЇЗДгІЗНГЬЪНЮЊЃК5COЃЈgЃЉ+I2O5ЃЈsЃЉ=5CO2ЃЈgЃЉ+I2ЃЈsЃЉЁїH=-1377.22kJ/molЃЌЙЪД№АИЮЊЃК5COЃЈgЃЉ+I2O5ЃЈsЃЉ=5CO2ЃЈgЃЉ+I2ЃЈsЃЉЁїH=-1377.22kJ/molЁЃ
=-1377.22kJ/molЃЌЫљвдЦфШШЛЏбЇЗДгІЗНГЬЪНЮЊЃК5COЃЈgЃЉ+I2O5ЃЈsЃЉ=5CO2ЃЈgЃЉ+I2ЃЈsЃЉЁїH=-1377.22kJ/molЃЌЙЪД№АИЮЊЃК5COЃЈgЃЉ+I2O5ЃЈsЃЉ=5CO2ЃЈgЃЉ+I2ЃЈsЃЉЁїH=-1377.22kJ/molЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПХЈСђЫсКЭЭдкМгШШЪБЗДгІ,ЩњГЩЖўбѕЛЏСђЦјЬхЕФЬхЛ§ЮЊ3.36LЃЈБъзМзДПіЯТЃЉЁЃвбжЊЃКCuЃЋ2H2SO4(ХЈЃЉ![]() CuSO4ЃЋSO2ЁќЃЋ2H2OЁЃЪдМЦЫуЃК
CuSO4ЃЋSO2ЁќЃЋ2H2OЁЃЪдМЦЫуЃК
ЃЈ1ЃЉЗДгІКѓЩњГЩСђЫсЭЕФЮяжЪЕФСПЃЛ
ЃЈ2ЃЉНЋЩњГЩЕФСђЫсЭХфжЦГЩ500mLШмвКЃЌдђИУШмвКжаШмжЪЕФЮяжЪЕФСПХЈЖШЪЧЖрЩйЃП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌНЋ0.1mol/LЕФЧтбѕЛЏФЦгы0.06mol/LСђЫсШмвКЕШЬхЛ§ЛьКЯ,ИУЛьКЯШмвКЕФpHЕШгкЃЈ ЃЉ
AЃЎ1.7 BЃЎ2.0 CЃЎ12.0 DЃЎ12.4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгаЯТСаЪЎжжЮяжЪЃКЂйесЬЧЂкТСЂлAl2ЃЈSO4ЃЉ3ЂмCO2ЂнH2SO4ЂоBaЃЈOHЃЉ2ЂпКьКжЩЋЕФЧтбѕЛЏЬњНКЬхЂрАБЫЎЂсЯЁбЮЫс
ЃЈ1ЃЉЩЯЪіЮяжЪжаЪєгкЕчНтжЪЕФгаЃК ЃЈЬюађКХЃЉЃЛ
ЃЈ2ЃЉЧјБ№ЂпгыЂрЕФЗНЗЈЃК ЃЛ
ЃЈ3ЃЉЂлдкЫЎжаЕФЕчРыЗНГЬЪНЮЊ _ЃЌ17.lgИУЮяжЪШмгкЫЎХфГЩ250mLШмвКЃЌЮяжЪЕФСПХЈЖШЮЊ______________mol.L-1ЃЛ
ЃЈ4ЃЉЩЯЪіОХжжЮяжЪжагаСНжжЮяжЪдкЫЎШмвКжаПЩЗЂЩњЗДгІЧвРызгЗНГЬЪНЮЊЃКH++OH-=H20ЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ______________ЃЛ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкТэСхЪэгзУчЕФХрбјвКжаЃЌГ§СЫБиашЕФЮЂСПдЊЫиЁЂNH4+ЁЂPO43ЉКЭCO2ЭтЃЌЛЙБиашЕФДѓСПдЊЫига
A. CЁЂHЁЂOЁЂNЁЂP B. KЁЂCaЁЂMgЁЂS
C. MnЁЂMoЁЂCuЁЂZn D. KЁЂCaЁЂMgЁЂFe
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПTЁцЪБЃЌЬхЛ§ОљЮЊ0.5LЕФСНИіКуШнУмБеШнЦїжаЗЂЩњПЩФцЗДгІЃК2A(g)+B(g) ![]() 2C(g)ЁїH=-QkJ/mol(Q>0)ЁЃБЃГжЮТЖШВЛБфЃЌЪЕбщВтЕУЦ№ЪМКЭЦНКтЪБЕФгаЙиЪ§ОнШчЯТБэЃК
2C(g)ЁїH=-QkJ/mol(Q>0)ЁЃБЃГжЮТЖШВЛБфЃЌЪЕбщВтЕУЦ№ЪМКЭЦНКтЪБЕФгаЙиЪ§ОнШчЯТБэЃК
ШнЦї БрКХ | Ц№ЪМЪБИїЮяжЪЮяжЪЕФСП/mol | ДяЦНКтЪБЬхЯЕФмСПЕФБфЛЏ | ||
A | B | C | ||
Ђй | 2 | 1 | 0 | ЗХШШ 0.75QkJ |
Ђк | 0.4 | 0.2 | 1.6 | |
ЯТСаа№Ъіжае§ШЗЕФЪЧЃЈ ЃЉ
A. ШнЦїЂйЁЂЂкжаЗДгІЕФЦНКтГЃЪ§ОљЮЊ4
B. ШнЦїЂкжаДяЕНЦНКтЪБЗХГіЕФШШСПЮЊ0.05QkJ
C. ЯђШнЦїЂйжаЭЈШыКЄЦјЃЌЦНКтЪБAЕФзЊЛЏТЪВЛБф
D. ЦфЫћЬѕМўВЛБфЃЌШєШнЦїЂкБЃГжКуШнОјШШЃЌдђДяЕНЦНКтЪБCЕФЬхЛ§ЗжЪ§аЁгк2/3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЦјЬхЭЈШыЫЎжаФмаЮГЩЕчНтжЪШмвКЕФЪЧ( )
AЃЎO2 BЃЎN2 CЃЎCH4 DЃЎHCl
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгавЛЗнКЌгаFeCl3КЭFeCl2ЙЬЬхЛьКЯЮяЃЌЮЊВтЖЈИїГЩЗжЕФКЌСПНјааШчЯТСНИіЪЕбщЃК
ЪЕбщ1ЃКЂй ГЦШЁвЛЖЈжЪСПЕФбљЦЗЃЌНЋбљЦЗШмНтЃЛ
Ђк ЯђШмНтКѓЕФШмвКжаМгШызуСПЕФAgNO3ШмвКЃЌВњЩњГСЕэЃЛ
Ђл НЋГСЕэЙ§ТЫЁЂЯДЕгЁЂИЩдяЕУЕНАзЩЋЙЬЬх17.22 gЁЃ
ЪЕбщ2ЃКЂй ГЦШЁгыЪЕбщ1жаЯрЭЌжЪСПЕФбљЦЗЃЌНЋбљЦЗШмНтЃЛ
Ђк ЯђШмНтКѓЕФШмвКжаЭЈШызуСПЕФCl2ЃЛ
Ђл дйЯђЂкЫљЕУШмвКжаМгШызуСПЕФNaOHШмвКЃЌЕУЕНКьКжЩЋГСЕэЃЛ
Ђм НЋГСЕэЙ§ТЫЁЂЯДЕгКѓЃЌМгШШзЦЩеЃЌЕНжЪСПВЛдйМѕЩйЃЌЕУЕНЙЬЬхЮяжЪ4gЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉШмНтЙ§ГЬжаЫљгУЕНЕФВЃСЇвЧЦїга___________________ЁЃ
ЃЈ2ЪЕбщЪвБЃДцFeCl2ШмвКЪБЭЈГЃЛсЯђЦфжаМгШыЩйСПЪдМС_____________КЭ_____________ЁЃ
ЃЈ3ЃЉЪЕбщ2ЭЈШызуСПCl2ЕФФПЕФЪЧ_____________ЃЛЩцМАЕФЛЏбЇЗДгІЕФРызгЗНГЬЪНЪЧ____________________ЁЃ
ЃЈ4МьЪіЪЕбщ2ЕФВНжшЂмжаГСЕэвбОЯДЕгИЩОЛЕФЗНЗЈЪЧ_____________ЁЃ
ЃЈ5ЃЉМгШШFeCl3ШмвКЃЌВЂНЋШмвКеєИЩЪБЃЌЭЈГЃВЛФмЕУЕНFeCl3ЙЬЬхЃЌЧывдЦНКтЕФЙлЕуНтЪЭЦфдвђЃЈЗНГЬЪНгыЮФзжЯрНсКЯРДЫЕУїЃЉ______________________ЁЃ
ЃЈ6ЃЉFeCl3ШмвКПЩвдгУгкжЙбЊЃЌжївЊЪЧвђЮЊFeCl3ШмвКФмЪЙбЊвКОлГСЃЌетЩцМАНКЬхЕФЬиадЁЃвдЯТЙигкНКЬхЕФЫЕЗЈВЛе§ШЗЕФЪЧ_____________ЁЃ
AЃЎНКЬхСЃзгФмЭИЙ§ТЫжНЃЌЕЋВЛФмЭИЙ§АыЭИФЄ
BЃЎНКЬхСЃзгОпгаНЯДѓЕФБэУцЛ§ЃЌФмЮќИНбєРызгЛђвѕРызгЃЌЙЪдкЕчГЁзїгУЯТЛсВњЩњЕчгОЯжЯѓ
CЃЎЯђFeЃЈOHЃЉ3НКЬхПЩвдВњЩњЖЁДяЖћаЇгІЃЌCuSO4ШмвКЁЂЫЎЕШЗжЩЂЯЕВЛФмВњЩњЖЁДяЖћаЇгІ
DЃЎЯђFeЃЈOHЃЉ3НКЬхжаЕЮМгСђЫсЃЌЛсЯШГіЯжКьКжЩЋГСЕэЃЌЫцКѓГСЕэЯћЪЇ
EЃЎдкЕААзжЪШмвКжаМгШыЯЁЕФCuSO4ШмвКЃЌПЩЪЙЕААзжЪбЮЮі
ЃЈ7ЃЉЭЈЙ§ЪЕбщЫљЕУЪ§ОнЃЌМЦЫуЙЬЬхбљЦЗжаFeCl3КЭFeCl2ЕФЮяжЪЕФСПжЎБШЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвашвЊ0.1mol/LNaOHШмвК450mLКЭ 0.5mol/LСђЫсШмвК450mL.ИљОнетСНжжШмвКЕФХфжЦЧщПіЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉШчЭМЫљЪОЕФвЧЦїжаХфжЦШмвКПЯЖЈВЛашвЊЕФЪЧ____________ЁЃЃЈЬюађКХЃЉвЧЦїCЕФУћГЦЪЧ________,БНЪЕбщЫљашВЃСЇвЧЦїEЙцИёКЭУћГЦЪЧ___________ЁЃ
ЃЈ2ЃЉЯТСаВйзїжаЃЌШнСПЦПЫљВЛОпБИЕФЙІФмга__________ЃЈЬюађКХЃЉ
AЃЎХфжЦвЛЖЈЬхЛ§зМШЗХЈЖШЕФБъзМШмвК | BЃЎГЄЦкжќДцШмвК |
CЃЎгУРДМгШШШмНтЙЬЬхШмжЪ | DЃЎСПШЁ220КСЩ§ЬхЛ§ЕФвК |
ЃЈ3ЃЉдкХфжЦNaOHШмвКЪЕбщжаЃЌЙВЫќВйзїОље§ШЗЃЌШєЖЈШнЪБбіЪгПЬЖШЯпЃЌдђЫљХфжЦШмШмвКХЈЖШ_____________0.1mol/LЃЈЬюЁАДѓгкЁБЁАЕШгкЁБЛђЁАаЁгкЁБЃЌЯТЭЌЃЉЁЃШєNaOHШмвКЮДРфШДМДзЊвЦжСШнСПЦПЖЈШнЃЌдђЫљХфжЦШмвКХЈЖШ__________0.1mol/LЁЃ
ЃЈ4ЃЉИљОнМЦЫуЕУжЊЃКЫљашжЪСПЗжЪ§ЮЊ98%ЁЂУмЖШЮЊ1.84g.cm-3ЕФХЈСђЫсЕФЬхЛ§ЮЊ__________mLЃЈМЦЫуНсЙћБЃСєвЛЮЛаЁЪ§ЃЉЁЃШчЙћЪЕбщЪвгаl0mLЁЂ25mLЁЂ50mLСПЭВЃЌЃЌгІбЁгУ__________mLЙцИёЕФСПЭВзюКУЁЃ
ЃЈ5ЃЉШчЙћЖЈШнЪБВЛаЁаФГЌЙ§ПЬЖШЯпЃЌгІШчКЮВйзї___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com