
����Ŀ��T��ʱ�������Ϊ0.5L�����������ܱ������з������淴Ӧ��2A(g)+B(g) ![]() 2C(g)��H=-QkJ/mol(Q>0)�������¶Ȳ��䣬ʵ������ʼ��ƽ��ʱ���й��������±���
2C(g)��H=-QkJ/mol(Q>0)�������¶Ȳ��䣬ʵ������ʼ��ƽ��ʱ���й��������±���
���� ��� | ��ʼʱ���������ʵ���/mol | ��ƽ��ʱ��ϵ�����ı仯 | ||
A | B | C | ||
�� | 2 | 1 | 0 | ���� 0.75QkJ |
�� | 0.4 | 0.2 | 1.6 | |
������������ȷ���ǣ� ��
A. �����������з�Ӧ��ƽ�ⳣ����Ϊ4
B. �������дﵽƽ��ʱ�ų�������Ϊ0.05QkJ
C. ����������ͨ�뺤����ƽ��ʱA��ת���ʲ���
D. �����������䣬�������ڱ��ֺ��ݾ��ȣ���ﵽƽ��ʱC���������С��2/3
���𰸡�C
������������������������вμӷ�Ӧ��A�����ʵ���=2mol��![]() =1.5mol����
=1.5mol����
2A��g��+B��g��![]() 2C��g��
2C��g��
��ʼ��mol���� 2 1 0
ת����mol����1.5 0.75 1.5
ƽ�⣨mol����0.5 0.25 1.5
���º����£�������ȫת��������ʽ��߿��Եõ�2molA��1mol��������������ӦΪ��ȫ��Чƽ�⣬ƽ��ʱ����ֵ����ʵ�����ȣ�����A����ʼ���ʵ���Ϊ0.4mol��С��ƽ��ʱ��0.5mol��A�������¶���ȣ��٢���ƽ�ⳣ��K=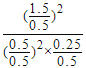 =18����A��ȷ��B�����з�Ӧ����������������������ӦΪ��ȫ��Чƽ�⣬ƽ��ʱB�����ʵ�����ȣ����������յ�����Ϊ��0.25-0.2��mol��QkJ/mol=0.05QkJ����B����C�����������£�����������ͨ�뺤��������ֵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���ƽ��ʱA��ת���ʲ��䣬��C����D��ƽ��ʱ��������C���������Ϊ
=18����A��ȷ��B�����з�Ӧ����������������������ӦΪ��ȫ��Чƽ�⣬ƽ��ʱB�����ʵ�����ȣ����������յ�����Ϊ��0.25-0.2��mol��QkJ/mol=0.05QkJ����B����C�����������£�����������ͨ�뺤��������ֵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���ƽ��ʱA��ת���ʲ��䣬��C����D��ƽ��ʱ��������C���������Ϊ![]() =
=![]() �������������䣬�����������ֺ��ݾ��ȣ��淴Ӧ���У��¶Ƚ��ͣ���Ӧ������C�ķ����ƶ�������2molCʱ����������С1mol����ﵽƽ��ʱC�������������
�������������䣬�����������ֺ��ݾ��ȣ��淴Ӧ���У��¶Ƚ��ͣ���Ӧ������C�ķ����ƶ�������2molCʱ����������С1mol����ﵽƽ��ʱC�������������![]() ����D����ѡA��
����D����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĹ�ҵ����ԭ�����漰������ԭ��Ӧ����
A. ���� B. ���� C. ���� D. �ռ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������г���NO2�������ֲ�ͬ�����·�����Ӧ��![]()
ʵ����NO2��Ũ����ʱ��ı仯���±�������������N2O4����

����˵����ȷ����
A. ʵ��2��ʵ��1�ķ�Ӧ���������С
B. ʵ��2��ʵ��lʹ����Ч�ʸ��ߵĴ���
C. ʵ��2��ʵ��3���жϸ÷�Ӧ�Ƿ��ȷ�Ӧ
D. ʵ��1��ʵ��3��ƽ�ⳣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ���ʵ������������ȷ����( )
A��CaCO3��ˮ���ܽ�Ⱥ�С���䵼����������������CaCO3���������
B��CaCO3��ˮ���ܽ�Ⱥ�С�����ܽ��CaCO3ȫ�����룬����CaCO3��ǿ�����
C�������Ͱ�����ˮ��Һ�����Զ��ܺã�����������ǿ�����
D��ˮ�ѵ��룬��ˮ���������磬ˮ�Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⼰�仯����������������ͿƼ��ȷ��涼������Ҫ��Ӧ�á��ش��������⣺
��1���ⲻ������ˮ���������ڵ⻯����Һ�����ɶ�����ӣ���Ӧ���£�
��I2��s��+I-��aq��![]() I3-��aq����H<0����I2��s��+2I-��aq��
I3-��aq����H<0����I2��s��+2I-��aq��![]() I42-��aq��
I42-��aq��
��Ӧ����ƽ�ⳣ���ı���ʽΪK=____________���¶�����ʱ����Ӧ����ƽ�ⳣ����____________����������������С��������������
��2����������һ���¶��£��ɷ������¿��淴Ӧ��W��s��+I2��g��![]() WI2��g����ȷ��ȡ0.508g���0.736g�����ٷ�����50.0mL���ܱ������У�������ʹ�䷴Ӧ����ͼ�ǻ�������е�WI2���������ʵ�����ʱ��仯��ϵ��ͼ��[n��WI2����t]��������������0��t2ʱ������ķ�Ӧ�¶�Ϊ450��������������t2ʱ�̿�ʼ���ķ�Ӧ�¶�Ϊ530��
WI2��g����ȷ��ȡ0.508g���0.736g�����ٷ�����50.0mL���ܱ������У�������ʹ�䷴Ӧ����ͼ�ǻ�������е�WI2���������ʵ�����ʱ��仯��ϵ��ͼ��[n��WI2����t]��������������0��t2ʱ������ķ�Ӧ�¶�Ϊ450��������������t2ʱ�̿�ʼ���ķ�Ӧ�¶�Ϊ530��

���÷�Ӧ��H_________0������>������<������
����Ӧ�ӿ�ʼ��t1��t1=3min��ʱ���ڵ�ƽ������v��I2��= ____________
����450��ʱ���÷�Ӧ��ƽ�ⳣ��K=____________��
���ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����____________ ����ѡ����ĸ��
A.I2��WI2��Ũ�����
B.��λʱ���ڣ����������ĵ����ʵ����뵥�ʵ����ɵ����ʵ������
C.�����ڻ��������ܶȲ��ٸı�
D.����������ѹǿ�������仯
��3��I2O5�ǰ�ɫ��ĩ״���壬������������ʹH2S��CO��HC1���������ںϳɰ���ҵ�г���I2O5����������CO�ĺ�����
��֪����2I2��s��+5O2��g����2I2O5��s����H��-75.56kJmol-1
��2CO��g��+O2��g����2CO2��g����H��-566.0kJmol-1��
д��CO��g����I2O5��s����Ӧ������̬I2���Ȼ�ѧ����ʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ָ������������½���ѧ��ת��Ϊ���ܵ�װ��,�乤��ԭ����ͼ��ʾ�������й������ص�˵���������( )
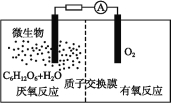
A.������Ӧ����CO2����
B.����ٽ��˷�Ӧ�е��ӵ�ת��
C.����ͨ������Ĥ�Ӹ���������������
D.����ܷ�ӦΪC6H12O6+6O2=6CO2+6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����β����������ȼ�ϵ��Ϊ����ԭ���ⶨCO��Ũ��,��װ����ͼ��ʾ,�õ���е����Ϊ������-������,����O2-�����ڹ������NAMCON�������ƶ�������˵������ȷ����( )

A.��������ͨ���ĵ���Խ��,CO�ĺ���Խ��
B.����ʱ�����ɵ缫aͨ���������NAMCON����缫b
C.����ʱ�缫b������,�����ɵ缫a����缫b
D.��������������1 mol O2-ͨ��ʱ,����ת��2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С���� 0.50 mol/L NaOH ��Һ�� 0.50 mol/L H2SO4 ��Һ�����к��ȵIJⶨ��
��.���� 0.50 mol/L NaOH ��Һ
(1��ʵ���д�ԼҪʹ�� 245 mL NaOH ��Һ,��������Ҫ���� NaOH ���� g��
(2���ӱ���ѡ����� NaOH ��������Ҫ������ (���������

��.�ⶨ�к��ȵ�ʵ��װ����ͼ��ʾ��

(3��д��ϡ�����ϡ NaOH ��Һ��Ӧ��ʾ�к��ȵ��Ȼ�ѧ����ʽ (�к���Ϊ 57.3 kJ/mol����

���¶Ȳ��ƽ��ֵΪ__________��
��ʹ������ NaOH ��Һ��Ͼ��ȵ���ȷ������ (����ĸ����
A�����¶ȼ�С�Ľ��� B���ҿ�ӲֽƬ�ò���������
C����������ձ� D���������¶ȼ��ϵĻ��β������������ؽ���
�۽�����Ϊ 0.50 mol/L NaOH ��Һ�� 0.50 mol/L ������ܶȶ��� 1g/cm3���кͺ�������Һ�ı����� c = 4.18 J/(g�����������к��� �� H= ________(�������С�����һλ����
������ʵ������ 57.3 kJ/mol ��ƫ��������ƫ���ԭ�������__________(����ĸ����
A��ʵ��װ�ñ��¡�����Ч����
B����ȡ NaOH ��Һ�����ʱ���Ӷ���
C���ֶ�ΰ� NaOH ��Һ����ʢ�������С�ձ���
D�����¶ȼƲⶨ NaOH ��Һ��ʼ�¶Ⱥ�ֱ�Ӳ��� H2SO4 ��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������Ԫ���� �� ��
A. ��Ԫ�� B. ��Ԫ�� C. ��Ԫ�� D. ̼Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com