
【题目】工业上用CO生产甲醇的反应为CO(g)+2H2(g)CH3OH(g) △H=akJ/mol.图1表示反应中能量的变化;图2表示一定温度下,在体积固定为1L的密闭容器中加入2molH2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图..下列叙述错误的是( )
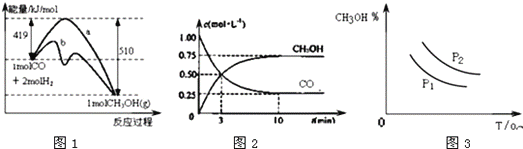
A. CO和H2合成CH3OH的反应:△H<0,△S<0
B. 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
C. 图1中曲线b可表示使用了催化剂的能量变化情况
D. 图3中曲线可表示在不同压强P1.P2(P1<P2)条件下甲醇百分含量随温度变化的情况
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含离子键的化合物是离子化合物,含共价键的化合物是共价化合物
B.离子键的形成过程中一定有电子得失
C.第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键
D.离子键与共价键的本质都是静电作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的电负性由小到大的顺序为________________。
(2)C的最高价氧化物分子是________(填“极性”或“非极性”)分子。
(3)与B同主族元素X,其气态氢化物是同主族元素的氢化物中沸点最高的,解释X的气态氢化物极易溶于水的原因:①_______________②_______________
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为____;E(CO)5在一定条件下发生分解反应:E(CO)5===E(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是________________。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
体心立方晶胞和面心立方晶胞中E原子的配位数之比为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 氢能、核能都是无污染的高效能源
B. 把煤转化为液态燃料可提高煤的燃烧效率
C. 推广使用太阳能、风能、海洋能,有利于缓解温室效应
D. 升温,能增大单位体积活化分子百分数,所以反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________。
(2)上述反应中氧化剂是______(填化学式),被氧化的元素是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增大C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运动员无论是在比赛或者是训练时都是需要大量的体力消耗,需比较快地补充能量,可以饮用葡萄糖水。则葡萄糖在人体内发生的主要反应是( )
A.酯化反应B.氧化反应C.还原反应D.水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解
④ 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 mL ,量取浓硫酸所用的量筒的规格是 。
(从下列中选用 A. 10mL B. 25mL C. 50mL D. 100ml)
(2)第③步实验的操作是
。
(3)第⑤步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的液凹面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为25℃时某些弱酸的电离平衡常数;下边图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
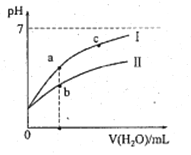
弱酸的电离平衡常数(25℃) | |
CH3COOH | HClO |
Ka=1.8×10-5 | Ka=3.0×10-8 |
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH-)+c(CH3COO-)>NaClO溶液的c(OH-)+c(C1O-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com