
【题目】下列方程式书写正确的是
A.碳酸的电离方程式:H2CO3 ![]() 2H+ + CO32-
2H+ + CO32-
B. 硫化钠水解: S2-+2H2O![]() H2S +2OH-
H2S +2OH-
C.往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+ S2-(aq) = Ag2S(s)
D.用醋酸除水垢: 2CH3COOH + CaCO3 = 2CH3COO- + Ca2+ + H2O + CO2↑
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z的原子序数依次增大,在周期表中Y分别与X、Z相邻。回答下列问题:
(1)若X、Y和Z的单质都为金属,Y与Z左右相邻,Z的单质被称为“国防金属”。则Y的单质在O2中燃烧产物中含有的化学键为____________________________。
(2)若X、Y和Z位于同一周期,高纯度Y单质常用于制造太阳能电池。则除去Y的氧化物中所含X氧化物杂质的方法是________________过滤、洗涤、干燥。
(3)若X原子最外层电子数是电子层数的2倍,Z与Y同主族,则X、Y、Z的简单气态氢化物中,沸点最高的是________________。(填化学式)
(4)若Y的原子序数等于X的2倍,T是Z的气态氢化物。
①写出Z2X对应的水化物分子的电子式________________。
②M是短周期中原子半径最大的元素,由M、X、Y元素组成的一种化合物与T的水溶液反应产生刺激性气味的气体,溶液变浑浊。写出反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有甲、乙、丙三种物质:
甲![]() 乙
乙 ![]()
分子式 | C9H8O |
部分性质 | 能使Br2/CCl4褪色 |
丙
(1)乙中含有的官能团的名称为_______________;
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
![]()
其中反应II的条件是___,反应III的化学方程式为______(不需注明反应条件);
(3)由甲出发合成丙的路线之一如下:

(a)写出反应③化学方程式________;
(b)丙的结构简式为_______________;
(c)D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式_______。
a.苯环上的一氯代物有两种
b.在空气中易被氧化,遇FeCl3溶液显紫色
c.能与Br2/CCl4发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷气式飞机在对流层中飞行时排放的尾气NO,能进行下列反应:O3→O2+O;NO+O3→NO2+O2,NO2+O→NO+O2,则NO在这些反应中的作用是( )
A.催化剂B.还原剂C.氧化剂D.中间产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长征2号火箭承担运载“神六”的使命。氢化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭发射的优良炸药。下列说法正确的是( )
A. LiH、LiD、LiT的摩尔质量之比为1:2:3
B. 它们互称同分异构体
C. H、D、T之间互称同素异形体
D. 它们都是强还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g) ![]() N2O4(g) △H<0。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
N2O4(g) △H<0。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
A. 增大容器体积
B. 温度压强不变,充入N2O4(g)
C. 温度体积不变,充入NO2(g)
D. 容器容积不变,降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为________。
(2)进水pH对氨氮去除率和出水pH的影响如图所示
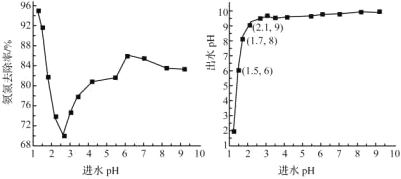
①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是_______
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是______
③进水pH应控制在______左右为宜。
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是_______(填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
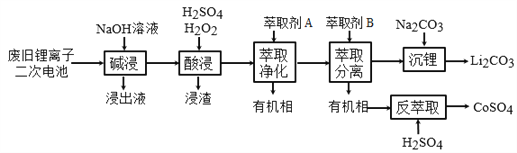
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
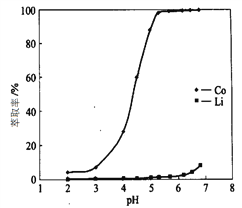
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
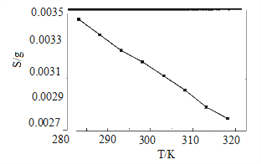
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com