
 2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置.
2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置.

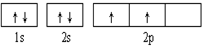 ,
,


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| A、0.044mol/L |
| B、0.44mol/L |
| C、4.4mol/L |
| D、44mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为电解水的装置,闭合开关s后,观察到电压表示数为6.0V,电流表示数为100mA.
如图所示为电解水的装置,闭合开关s后,观察到电压表示数为6.0V,电流表示数为100mA.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com