
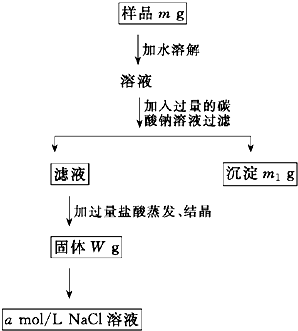
 欲用含有少量氯化钙的氯化钠固体,配制100mL a mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:
欲用含有少量氯化钙的氯化钠固体,配制100mL a mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:

科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以X浓度变化表示的反应速率为0.25 mol?L-1?s-1 |
| B、12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的1/5 |
| C、若增大X的浓度,则物质Y的转化率减小 |
| D、若该反应的△H<0,升高温度,平衡常数K减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com