
下图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li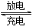 Li7Ti5 O12 。装置(Ⅱ)为电解池的示意图。当闭合K1,断开K2时,Fe电极附近溶液先变红。下列说法正确的是( )
Li7Ti5 O12 。装置(Ⅱ)为电解池的示意图。当闭合K1,断开K2时,Fe电极附近溶液先变红。下列说法正确的是( )
A.闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
B.闭合K1,断开K2时,当0.1 mol Li+从A极区迁移
到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下)
C.取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5 O12 -3e-= Li4Ti5 O12+3 Li+
D.若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-=H2↑
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列关于Na2CO3的分类叙述错误的是( )
A.Na2CO3 俗名为纯碱,故它属于碱类 B.Na2CO3属于钠盐
C.Na2CO3属于碳酸盐 D.Na2CO3 属于含氧酸盐
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
下列实验中,所采取的分离方法与对应原理都正确的是
选项 | 目的 | 分离方法 | 原理 |
A | 除去KCl中的MnO2 | 蒸发结晶 | 溶解度不同 |
B | 除去碘中的NaCl | 加热、升华 | NaCl的熔点高,碘易升华 |
C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
下列实验方案能达到目的的是
A.除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤
B.实验室获取少量纯净的水:蒸馏自来水
C.提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤
D.提取碘水中的碘:加入适量乙醇,振荡、静置、分液
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:填空题
过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJmol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJmol-1
H2O(l)=H2O(g) △H=+44kJmol-1
则反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)的△H=_________
臭氧(O3)可以使湿润 的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
①还原产物的化学式为_________
②配平后的化学方程式是__________________

(4)O3 可由臭氧发生器(原理如图所示)电解稀硫酸制得。
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:选择题
由短周期元素组成的中学常见物质A、B、C、D、E、X,存在下图转化关系:
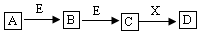 (部分生成物和反应条件略去)。下列推断错误的是( )
(部分生成物和反应条件略去)。下列推断错误的是( )
A. 若D与盐酸反应,可生成A和B,则X一定是H2O
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:选择题
著名化学家徐光宪获得“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A. 铈(Ce)元素在自然界中主要以化合态形式存在
B. 铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
C. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+ = Ce3++Fe3+
D. 四种稳定的核素 、
、 、
、 、
、 ,它们互称为同位素
,它们互称为同位素
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学卷(解析版) 题型:选择题
已知:有机物A可发生如下图所示转化关系,且E能发生银镜反应,C不能发生银镜反应,则A的结构可能有(不考虑立体结构)

A.13种 B.9种 C.8种 D.10种
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省高三10月月考化学卷(解析版) 题型:填空题
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(3) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。

(4)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com