
����һ����Ҫ�Ļ�����Ʒ���ǵ��ʹ�ҵ���л��ϳɹ�ҵ�Լ��������ᡢ��κʹ���ȵ�ԭ�ϡ�
��1����һ���¶��£��ڹ̶�������ܱ������н��п��淴Ӧ��N2+3H2 2NH3���ÿ��淴Ӧ�ﵽƽ��ı�־��________________��
2NH3���ÿ��淴Ӧ�ﵽƽ��ı�־��________________��
A��3v(H2)��=2v(NH3)��
B����λʱ������m mol N2��ͬʱ����3m mol H2
C�������ڵ���ѹǿ������ʱ����仯
D�����������ܶȲ�����ʱ��仯
E��a molN��N�����ѵ�ͬʱ����6amolN��H������
F��N2��H2��NH3�ķ�����֮��Ϊ1��3��2
��2��ij��ѧ�о���ѧϰС��ģ�ҵ�ϳɰ��ķ�Ӧ�����ݻ��̶�Ϊ2L���ܱ������ڳ���1molN2��3molH2��������ʴ�����������Ժ��Բ��ƣ�����һ���¶�ѹǿ�¿�ʼ��Ӧ������ѹ���Ƽ��������ѹǿ�ı仯���£�
��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
��ӷ�Ӧ��ʼ��25minʱ����N2��ʾ��ƽ����Ӧ����= �����¶���ƽ�ⳣ��K= ��
��3�� ���úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�����Ҫ��Ӧ���£�
��CO(g)+2H2(g) CH3OH(g) ��H=��99kJ��mol��1
CH3OH(g) ��H=��99kJ��mol��1
��CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H=��58 kJ��mol��1
CH3OH(g)+H2O(g) ��H=��58 kJ��mol��1
��CO2(g)+H2(g) CO(g)+H2O(g) ��H
CO(g)+H2O(g) ��H
ͼ1������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ�������� ����Ӧ�۵ġ�H= kJ��mol��1��

��4���ϳ��������n(H2)/n(CO+CO2)=2.60ʱ��ϵ�е�COƽ��ת���ʦ�(CO)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ��ͼ�е�ѹǿp1��p2��p3�ɴ�С��˳��Ϊ ����(CO)���¶����߶���С����ԭ���� ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ������10�¸߿�ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼװ��(��)Ϊһ�ֿɳ������ӵ�ص�ʾ��ͼ���õ�س䡢�ŵ�Ļ�ѧ����ʽΪ��Li4Ti5O12+3Li Li7Ti5 O12 ��װ��(��)Ϊ���ص�ʾ��ͼ�����պ�K1���Ͽ�K2ʱ��Fe�缫������Һ�ȱ�졣����˵����ȷ����( )
Li7Ti5 O12 ��װ��(��)Ϊ���ص�ʾ��ͼ�����պ�K1���Ͽ�K2ʱ��Fe�缫������Һ�ȱ�졣����˵����ȷ����( )
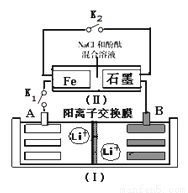
A���պ�K1���Ͽ�K2ʱ������Fe�缫��ʯī�缫������װ��(��)�з������ܷ�ӦΪ��2NaCl+2H2O 2NaOH+Cl2��+H2��
2NaOH+Cl2��+H2��
B���պ�K1���Ͽ�K2ʱ����0.1 mol Li����A����Ǩ��
��B������������Fe�缫�ϲ������������Ϊ1.12 L����״���£�
C��ȡ������ӵ�س�磬�缫AΪ������������������Ӧ���缫�Ϸ����ĵ缫��ӦʽΪ��Li7Ti5 O12 -3e��= Li4Ti5 O12��3 Li+
D������ʼʱ���Ͽ�K1���պ�K2��һ��ʱ���ʯī�缫�����Ժ�ɫ����õ缫��ӦΪ��2H++2e-=H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���½�����������Ŷ��и����ϵڶ����¿���ѧ���������棩 ���ͣ������
������BN����һ����Ҫ�Ĺ����մɲ��ϣ���ش��������⣺
��1����̬Bԭ�ӵĵ����Ų�ʽΪ___________��B��N��ȣ��縺�Խϴ����_________��
��2����BF3�����У� Bԭ�ӵ��ӻ��������Ϊ___________�� BF3���ӵĿռ乹��Ϊ_____________��
��3�������������ڸ��¸�ѹ�£�����ת��Ϊ��������������ṹ����ʯ���ƣ� Ӳ������ʯ�൱�������߳�Ϊ361.5pm�������������к���__________����ԭ�ӡ�������������ܶ���___________g��cm-3��ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���½�����������Ŷ��и����ϵڶ����¿���ѧ���������棩 ���ͣ�ѡ����
��NAΪ����٤�����������������д������
A��1mol������������������Ӧת�Ƶĵ�����ΪNA
B����״���£�22.4L�ױ��к�C-H����ĿΪ8NA
C����״���£�11.2L�����к���0.5NA����ԭ��
D�����³�ѹ�£�����NA����������ϩ���ӵĻ����������Ϊ28g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���½�����������Ŷ��и����ϵڶ����¿���ѧ���������棩 ���ͣ�ѡ����
���й���Cl��N��S�ȷǽ���Ԫ�ص��ʼ��仯�����˵���������
A��Ư�۵ijɷ��Ǵ�����ƺ��Ȼ���
B��ʵ���ҿ���NaOH��Һ����SO2��NO2
C����Ũ��ˮ�ε��������ƹ����п�����ȡ����
D��CO2��NO2��SO2������H2O��Ӧ���䷴Ӧԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�������ʡ����10���¿���ѧ���������棩 ���ͣ�ѡ����
��ס��������ݻ���Ϊ1L�ĺ��������У��ֱ����2mol A��2mol B��1mol A��1mol B����ͬ�¶��£�������Ӧ��A��g��+B��g��?xC��g������H��0�������������c��A����ʱ��t�ı仯��ͼ��ʾ������˵����ȷ���ǣ� ��

A��x���ܵ���2
B���ס����������з�Ӧ��ƽ��ʱ��ƽ�ⳣ��K���ף���K���ң�
C�������������¿�ʹ�ס��������ڸ����ʵ����������ͬ
D��������������ٳ���2 mol A��2 mol B����ƽ��ʱ��������0.78 mol•L��1��c��A����1.56 mol•L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�������ʡ����10���¿���ѧ���������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ���ǣ� ��
A����״����2.24LCO2ͨ��1mol•L-1100 ����������Һ�У�CO2+OH-=HCO3-
����������Һ�У�CO2+OH-=HCO3-
B����������Һ�м��������ˮAl3++4NH3��H2O=AlO2-+4NH4++2H2O
C��Na2Sˮ�⣺S2-+2H2O H2S+2OH-
H2S+2OH-
D�������ʵ�����NH4HCO3��NaOH����Һ�з�Ӧ��NH4++HCO3-+2OH-=CO32-+NH3��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ�ĵ���У��һ�ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
��ͼ��һ��ʵ ������ȡ������������Ϊԭ�Ͻ���һϵ�з�Ӧ��װ�ã��ش��������⡣����֪Cl2+SO2+2H2O=2HCl+H2SO4��
������ȡ������������Ϊԭ�Ͻ���һϵ�з�Ӧ��װ�ã��ش��������⡣����֪Cl2+SO2+2H2O=2HCl+H2SO4��

��1���a���������� ��
��2��Eװ�ò�����ɫ���������ԭ�� ��
��3��Fװ�õ�Ӳ�ʲ�������ʢ��̼�ۣ�����������ԭ��Ӧ�������ΪCO2��HCl����д��F�з�Ӧ�Ļ�ѧ����ʽ ��
��4��G����Ӧ�����е����� ��
a��һ��ʼ���а�ɫ���Dz��� b����ʼ����������Ȼ�������ɫ����
c����ʼ������ɫ���ǣ�һ���������ʧ d������������
��5��Gװ����ȷ��F����Ӧ����CO2������Ϊ��֤��CO2�Ĵ��ڣ�Ҫ��Gװ�ý��и��죬����װ�÷���Ҫ����� ��

��6��D����Һ��ɫ��ȥ������������ ��ԭ����������֣�
��ԭ����������֣�
һ�� ��
���� ��
Ϊȷ��������ԭ���е���һ�֣��������һ����ʵ�����֤�� �� ��
�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ�߶��ϵ�һ���¿���ѧ���������棩 ���ͣ������
Ǧ�����ǻ�ѧ��Դ��������ʱ�ĵ�ط�ӦΪ��
PbO2��Pb��2H2SO4===2PbSO4��2H2O��
�Իش�
(1)Ǧ���������ĵ缫������__________��
(2)����ʱ��Ǧ���ظ����ĵ缫��Ӧ��______________��
(3)Ǧ���ع���ʱ���������Һ���ܶ�__________(���С���������䡱����ͬ)��pH__________��
(4)�����Ǧ��������Դ��ⱥ��ʳ��ˮ��ȡCl2�����Ƶ�0.05molCl2ʱ���������ϵ���ڲ����ĵ�H2SO4�����ʵ�����____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com