
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电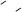 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示:
据此判断下列叙述中正确的是 ( )
A.放电时正极电极反应式PbO2 + SO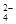 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充电时蓄电池负极应与电源正极相连接 |
| C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子 |
| D.电池放电时,溶液酸性增强 |
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出放电时负极上发生反应的化学方程式_____________________________。
(2)当蓄电池作为电源电解CuSO4溶液生成1.6 g Cu时,蓄电池内消耗H2SO4____________mol。
(3)给蓄电池充电时,若要使3.03 g PbSO4转变为Pb和PbO2,需要____________ mol的电荷量。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用硫酸溶液作电解质溶液。在放电时,两极发生的反应可分别表示为:
Pb+ SO42-![]() PbSO4+2e-
PbSO4+2e-
PbO2+4H++ SO42-+2e-![]() PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e-![]() Pb+ SO42-
Pb+ SO42-
PbSO4+2H2O-2e-![]() PbO2+4H++ SO42-
PbO2+4H++ SO42-
根据上述材料,回答(1)—(3)题。
(1)在放电时,下列说法正确的是( )
A.铅板为电源正极 B.铅板为电源负极
C.铅板在放电时发生氧化反应 D.铅板在放电时发生还原反应
(2)在蓄电池放电时,溶液的pH将( )
A.不变 B.升高 C.降低 D.无法确定
(3)在蓄电池生产和使用时,下列说法正确的是( )
A.生产和使用铅蓄电池时,不会造成环境污染
B.生产和使用铅蓄电池时,可能引起铅中毒和环境污染
C.使用铅蓄电池时,若铅板上有1 mol铅反应就消耗2molH2SO4
D.在使用时,电池内溶液的密度会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充
电时发生的化学反应可用下式表示:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O据此判断下列叙述
2PbSO4+2H2O据此判断下列叙述
正确的是
A.放电时负极电极反应式为:PbO2+4H+ + SO42-+2e-![]() PbSO4+2H2O
PbSO4+2H2O
B.充电时阴极电极反应式为:PbSO4+2e-![]() Pb+SO42-
Pb+SO42-
C.充电时,若要使1molPbSO4转变为Pb和PbO2,则需要通过2mol电子
D.放电时,H+向负极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com