
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
分析 该反应是一个反应前后气体体积不变的可逆反应,升高温度、增大压强、增大反应物浓度、加入催化剂等都可以增大反应速率,以此解答该题.
解答 解:①增大压强,单位体积内活化分子数增大,所以反应速率增大,故正确;
②升高温度,增大活化分子百分数,所以反应速率增大,故正确;
③通入O2,单位体积内活化分子数增大,所以反应速率增大,故正确;
④增加硫的量,不影响活化分子百分数或活化分子数,所以不影响反应速率,故错误;
⑤降低压强,降低单位体积内活化分子数,所以反应速率降低,故错误;
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,可以通过改变浓度、温度等方法改变反应速率,注意:固体或纯液体的物质的量多少不影响反应速率,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰熔化时水分子中共价键发生断裂 | |
| B. | 原子晶体中共价键越强硬度越大 | |
| C. | 晶体中分子间作用力越大,分子越稳定 | |
| D. | 氯化钠溶于水时离子键未被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
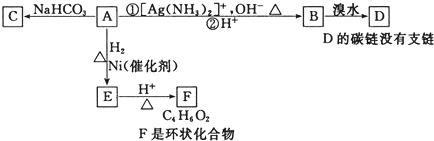
| A. | 化合物A中一定含有的官能团是醛基、羧基和碳碳双键 | |
| B. | 由A生成E发生还原反应 | |
| C. | F的结构简式可表示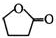 | |
| D. | 由B生成D发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 在过氧化钠中加入稀硫酸:O22-+4H+═2H2O+O2↑ | |
| C. | 澄清石灰水与过量的小苏打溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度比4:1 | B. | 分子数之比为4:11 | ||
| C. | 体积比11:4 | D. | 物质的量之比为4:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,丁烷是气体 | |
| B. | 丁烷与甲烷互为同系物 | |
| C. | 丁烷有正丁烷和异丁烷两种同分异构体 | |
| D. | 戊烷进行一氯取代后生成两种沸点不同的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
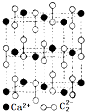 从结构的角度可以帮助我们更好的理解有机物的化学性质.
从结构的角度可以帮助我们更好的理解有机物的化学性质.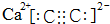 ,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3
,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3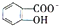 判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是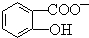 中-OH的氢原子形成分子内氢键,使其更难电离出H+.
中-OH的氢原子形成分子内氢键,使其更难电离出H+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com